재료
생체내/체외 재료
T. 루테아 Microalgae Ask Us Corp. (강릉, 한국)에서 입수했습니다. 스코폴라민, 플루오레세인, 헤마톡실린 및 에오신(H&E)은 동물 실험을 위해 Sigma-Aldrich(미국 미주리주 세인트루이스)에서 구입했습니다. Dulbecco's Modified Eagle's Medium(DMEM):F12, Dulbecco 인산염 완충 식염수(DPBS), 태아 소 혈청(FBS) 및 0.25% 트립신-EDTA 용액은 Life Technologies(Carlsbad, CA, USA)에서 구입했습니다. 10,000 U/mL 페니실린과 10,000 μg/mL 스트렙토마이신으로 구성된 항생제 용액은 Hyclone Laboratories Inc.(South Logan, UT, USA)에서 구입했습니다. 재조합 인간 TNF-α는 R&D 시스템(Minneapolis, MN, USA)에서 입수했습니다. 항세포외 신호 조절 키나아제(ERK), 항-c-jun N-말단 키나아제(JNK), 항-p38, 항-α-튜불린 및 항-β-액틴을 포함한 1차 항체는 Santa Cruz Biotechnology에서 구입했습니다. 미국 캘리포니아주 산타크루즈). 다른 1차 항체와 HRP(horseradish peroxydase) 결합 2차 항체는 Cell Signaling Technology, Inc(Beverly, MA, USA)에서 구입했습니다. 3-4,5-디메틸티아졸-2-일)-2,5-디페닐테트라졸륨 브로마이드(MTT)를 포함한 화학 물질은 Sigma-Aldrich(미국 미주리주 세인트루이스)에서 구입했습니다.
화학 분석 자료
PUFA는 Sigma-Aldrich(St. Louis, MO, USA)에서 구입한 37가지 PUFA 표준 물질이 포함된 용액을 사용하여 확인되었습니다. 발레르산은 내부 표준물질로 사용하기 위해 Sigma-Aldrich(미국 미주리주 세인트루이스)에서 구입했습니다. 삼불화붕소 메탄올 용액을 포함한 용매, N-헥산, Na2그래서4, 채널3PUFA를 추출하는 데 사용되는 Cl, MeOH 및 NaCl T. 루테아 Sigma-Aldrich (미국 미주리 주 세인트루이스)에서 구입했습니다.
윤리적 성명
본 연구는 한국과학기술연구원(KIST) 동물실험연구위원회(IACUC)의 승인을 받았습니다: KIST 제2020-002호, 강릉연구소. 안과 및 시력 연구에 동물을 사용합니다. 또한, 우리는 동물 연구: 생체 내 실험 보고(ARRIVE) 권장 사항을 따릅니다. 모든 절차는 해당 규정 및 지침을 준수하여 수행되었습니다.
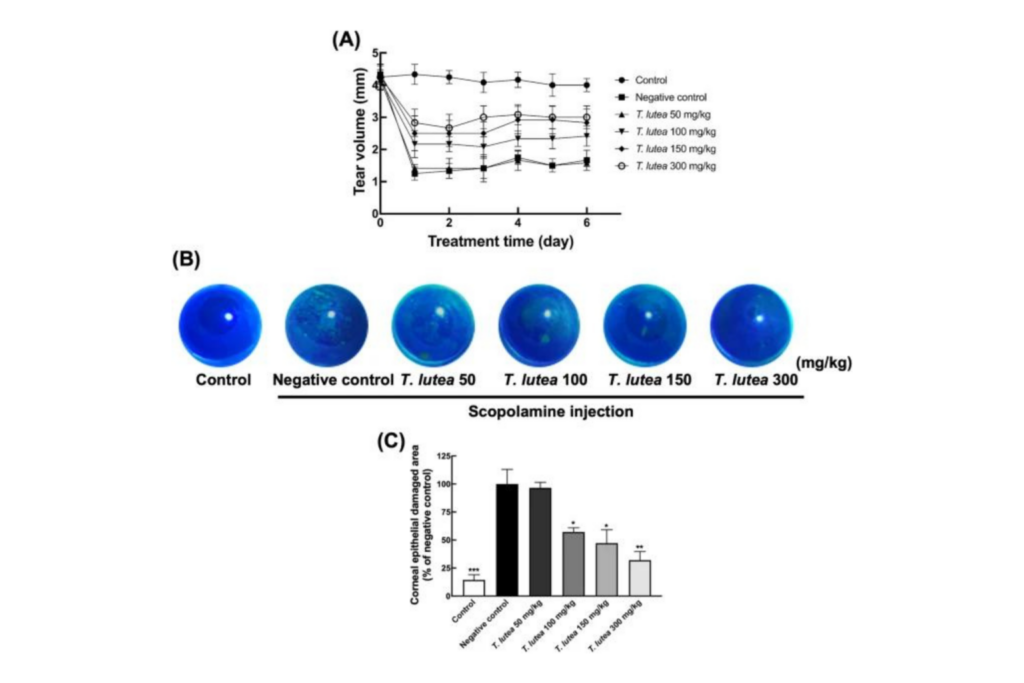
동물 실험 및 DES 모델 유도
마우스는 에어컨이 설치된 동물실에 보관되었으며 22°C ± 2°C, 50% ± 10% 습도 및 12시간 빛/12시간 어두운 일주기 주기로 유지되었습니다. 음식과 물은 자유롭게 제공되었습니다. 마우스를 일주일 동안 적응시킨 후 무작위로 6주령 수컷 BALB/c 마우스(오리엔트바이오, 경기도) 7마리를 5개 그룹으로 나누었다. DES는 인산염 완충 식염수(PBS; Sigma-Aldrich, St. Louis, MO, USA)에 희석된 스코폴라민 200 μL(2.5 mg/mL)를 복강 내 주사하여 매일 2회 마우스에서 실험적으로 유도되었습니다. T. 루테아 200 μL의 증류수에 0(차량 대조군), 100, 150 또는 300 mg/kg의 농도로 매일 마우스 그룹에 경구 투여했습니다. 대조군에는 스코폴라민이 포함되지 않은 PBS를 투여했습니다. 언제 T. 루테아 경구투여하였고 대조군과 DES군에서는 증류수 200 μL를 사용하였다. 눈물 생산은 1분 동안 눈을 감기 전 관자놀이 눈꺼풀의 아래쪽 1/3에 위치한 표준 Schirmer 테스트 스트립을 사용하여 2주 후에 정량화되었습니다. 그런 다음 스트립을 제거하고 밀리미터 단위의 습윤점 길이를 측정하여 Schirmer의 테스트 값을 결정했습니다. 각막 표면의 염색은 각막 표면 변화의 정도를 결정하는 데 사용되었습니다. 3% 플루오레세인을 하측 결막에 한 방울 주입한 후 각막 표면을 관찰하고 점수를 매겼다. 각막 염색은 맹목적으로 평가되었습니다. 마우스는 경추 탈구로 인해 안락사되었습니다. 각막은 마우스의 눈꺼풀을 가볍게 두드린 후 집게를 사용하여 안구에서 시신경을 잘라내어 각막을 제거했습니다. 수정체는 각막 내에서 제거되어 -80°C에 보관되었습니다. 집게를 사용하여 마우스의 아래턱에서 눈물샘을 제거하고, 당긴 부분의 표피를 잘라내어 얼굴의 아래쪽 절반을 드러냈습니다. 아래턱 근처의 눈물샘을 고정하고 제거한 후 빛을 차단하여 -80 °C에 보관했습니다.
조직학
각막 표피 및 눈물샘 조직을 수집하여 10% 포름알데히드에 고정한 후 파라핀 포매 및 절개를 위해 처리했습니다. 단면을 H&E로 염색하고 현미경(TE-2000U, Nikon, Tokyo, Japan)을 사용하여 40배율로 검사했습니다. 중앙 각막 상피 두께는 각 각막을 5개 부분으로 나누어 측정했습니다.
면역조직화학적(IHC) 분석을 위한 DAB 염색
BALB/c 마우스의 눈물샘 조직을 채취하여 10% 포름알데히드로 고정했습니다. 고정된 눈물샘 조직을 파라핀으로 포매하고 절편(5 μm)한 후 xylene(Jonsei, Tokyo, Japan)을 사용하여 3분간 3회에 걸쳐 파라핀을 제거했습니다. 절편을 100, 95, 70 및 50% 에탄올에서 1분 동안 수화시켰습니다. TRIS-EDTA 완충액(pH 9.0)을 사용하여 전자레인지로 눈물샘 항원을 추출했습니다. 3% 과산화수소를 조직 슬라이드에 15분 동안 적용한 후, 절편을 실온에서 1시간 동안 2% BSA로 차단했습니다. 절편을 CD45(Bio-RAD, MCA 1258GT, 1:100 희석)로 4°C에서 밤새 처리했습니다. PBS로 세척한 후 세포를 실온에서 2시간 동안 항토끼 IgG-HRP(Santa Cruz Biotechnology, Dallas, TX, USA, SC-2357, 1:100 희석)로 처리하고 3, 3'-디아미노벤지딘 테트라히드로클로라이드(Vector Laboratories, Burlingame, CA, USA). 슬라이드를 헤마톡실린으로 30초 동안 염색하고 수돗물로 헹구었습니다. 그런 다음 슬라이스를 덮개로 덮고 Permount™ 장착 매체(Thermo Fisher Scientific, Waltham, MA, USA)를 사용하여 장착했습니다. 모든 슬라이드는 광학 현미경(Olympus, CX43, Olympus Optical Co., Tokyo, Japan)을 사용하여 검사하고 사진을 찍었습니다. ImageJ 소프트웨어(버전 1.53, 미국 메릴랜드주 베데스다 국립보건원)48 정량적 데이터 분석을 수행하는 데 사용되었습니다.
ARPE-19 세포 배양
인간 망막 상피 ARPE-19 세포(American Type Culture Collection, ATCC, Manassas, VA, USA)를 10% FBS(HyClone Laboratories, Logan, UT)가 보충된 DMEM/F-12 배지(Gibco, Carlsbad, CA, USA)에서 배양했습니다. , USA) 및 1% 페니실린/스트렙토마이신(HyClone Laboratories). 세포는 2 × 10 의 밀도로 파종되었습니다.5 6웰 플레이트에 웰당 분주하고 배양하여 염증 및 소포체 반응을 유도했습니다.
세포 생존력
효과 T. 루테아 세포 생존력에 대한 이전 연구에서 설명한 대로 MTT 분석으로 평가했습니다.49 하지만 약간 수정했습니다. 세포를 96웰 배양 플레이트에 1.5 x 10 밀도로 플레이팅했습니다.4 세포/웰을 처리하고 24시간 동안 배양했습니다. 그런 다음 세포를 다양한 농도의 T. 루테아 그리고 추가로 24시간 동안 배양하였다. 각 웰의 상청액을 0.5 mg/mL의 MTT를 함유한 새로운 성장 배지로 교체하고 1시간 동안 배양했습니다. 상등액을 제거하고 생성된 포르마잔 침전물을 200 μL의 디메틸 설폭사이드에 용해시켰습니다. 흡광도는 570 nm에서 측정되었습니다. 세포 생존율은 음성 대조군과 비교하여 백분율로 상대적으로 계산되었습니다.
웨스턴 블롯 분석
항염증 효과의 기본이 되는 세포 신호 전달 경로를 결정하기 위해 웨스턴 블롯팅을 수행했습니다. T. 루테아 앞서 설명한 대로 연구49, 그러나 약간의 수정이 필요합니다. 융합성 ARPE-19 세포는 1% FBS 및 1% 항생제를 함유한 DMEM:F12에서 24시간 동안 굶어 죽었습니다. 그런 다음 세포를 다음으로 처리했습니다. T. 루테아 (50 및 100 μg/mL)을 2시간 동안 처리한 후 20 ng/mL의 TNF-α로 15분 동안 자극했습니다. 세포를 얼음처럼 차가운 DPBS로 3회 헹구고 프로테아제와 포스파타제 억제제의 칵테일이 보충된 단백질 추출 완충액(iNtRON Biotechnology, 경기도, 한국)에 용해시켰다. 용해물의 상청액을 원심분리(14,000×g, 30분, 4°C), DCTM 단백질 분석 키트(Bio-Rad, Hercules, CA, USA)를 사용하여 단백질 농도를 추정했습니다. 동일한 양(15-25μg)의 세포 단백질을 SDS-PAGE로 분리하고 PVDF 막으로 옮겼습니다. 막을 5% 소 혈청 알부민 또는 탈지유와 함께 배양한 다음 1차 항체(항-포스포-ERK, 항-ERK, 항-포스포-JNK, 항-JNK, 항-포스포-p38)의 1:2000 희석과 함께 배양했습니다. , 항-p38, 항-포스포-AKT, 항-AKT, 항-포스포-IκB-α, 항-IκB-α, 항-포스포-p65, 항-p65, 항-α-튜불린 및 항-β-작용 ) 4°C 및 12시간. 그런 다음 막을 TBS-T로 헹구고 1:10,000으로 희석된 항토끼 HRP 결합 2차 항체로 실온에서 1시간 동안 처리했습니다. SuperSignal West Femto Maximum Sensitivity Substrate(Thermo Fisher Scientific)를 사용하여 단백질 밴드를 검출하고 iBright CL1000 겔 문서화 시스템(Thermo Fisher Scientific)에서 시각화했습니다. 각 단백질 블롯의 밀도는 Image J 소프트웨어(버전 1.53, NIH)를 사용하여 결정되었습니다.48.
총 PUFA 추출 T. 루테아
총 PUFA는 다음에서 추출되었습니다. T. 루테아 폴치(Folch) 기법을 사용하여50. 간단히 말하면, 100mg의 샘플을 5mL의 CH가 들어 있는 바이알에 넣었습니다.3Cl:MeOH(2:1, v/v) 용액을 넣고 15분 동안 초음파 처리했습니다. 10,000rpm에서 5분 동안 원심분리하여 현탁액을 정화했습니다. 나2그래서4 상등액에 첨가한 후 여과하여 남은 물을 제거했습니다. 이 단계를 두 번 더 반복했습니다. 이어서, 용액을 질소 가스하에 농축하여 순수한 조류 지질을 얻었다.
지방산 메틸화
가스 크로마토그래피(GC) 분석을 위한 지질 샘플을 준비하기 위해 지방산 메틸화를 수행했습니다. 추출된 물질을 10mL 바이알에 첨가한 후 1mL의 0.5N NaOH:MeOH 혼합물을 첨가했습니다. 이 용액에는 400μg/mL의 내부 가닥(발레르산)이 포함되어 있습니다. 혼합물을 30초 동안 흔든 다음 80°C에서 20분 동안 배양했습니다. 혼합물을 실온에서 5분 동안 냉각시킨 후 삼불화붕소:MeOH 2 mL를 첨가하고 30초 동안 교반하였다. 혼합물을 80℃에서 20분 동안 배양한 후 10분 동안 냉각시켰다. 2 mL의 과포화 NaCl을 첨가하여 상 분리 및 지방산 수집을 유도했습니다. 다음으로 1.5mL N-헥산을 첨가하고 혼합물을 30초 동안 와동시킨 후 실온에서 20분 동안 냉각시켰다. 층을 분리하고 액체 상층액을 혼합물로부터 제거한 후 포화 Na2수지를 사용하여 물을 완전히 제거하였다.2그래서4 필터.
지방산의 식별
불꽃 이온화 검출기(FID; Agilent 7890A, Agilent Technologies, Wilmington, DE, USA)가 장착된 GC를 사용하여 지방산 메틸 에스테르(FAME)를 검사했습니다. 샘플(1μL)을 GC(J&W 112-88A7, Agilent Technologies, Wilmington, DE, USA)(100m × 250μm ID, 0.2μm 필름)의 HP-88 컬럼에 주입했습니다. GC 분석은 다음과 같이 수행되었습니다. 샘플을 처음에 140°C에서 5분간 유지한 다음 온도를 분당 4°C씩 올려 15분 동안 240°C까지 올렸습니다. 컬럼의 유속은 1mL/min으로 고정되었습니다. 분석을 위한 운반가스로는 질소가스를 사용하였으며, FID는 280℃, 분할비는 30:1로 설정하였다. FAME는 알려진 표준과 비교하여 식별되었습니다. 각 샘플은 GC 분석으로 3회 측정되었습니다.
통계 분석
모든 데이터는 SPSS 버전 18.0(IBM Co., Armonk, NY, USA)을 사용하여 Tukey의 사후 분석과 함께 일원 분산 분석을 사용하여 통계적으로 분석되었습니다. 각 실험에 대해 최소 3번의 독립적인 반복실험이 수행되었습니다.
[ad_2]