LC-Q-Orbitrap HRMS を使用したメタボローム プロファイリング
一般に、メタボローム研究では、 サルビア 負イオン化モードの種は正イオン化モードの種よりも効率的である傾向がある15この研究では、MSデータ分析にCompound Discoverer 2.1ソフトウェアが提供するオンラインおよびローカルデータベースの使用が含まれていました。さらに、以前のメタボロミクス研究から収集されたデータも使用されました。 サルビア 種は収集され、大量リストに統合され、ローカルデータベースとして実装されました。合計 2704 個の物質ピークが検出されました。 S.フルティコサ マイナスイオンモード分析で抽出します。マイナー信号をフィルタリングした後 (エリア < 10)4)、補足表に示すように、98 個の代謝物があり、そのうち 95 個が暫定的に同定されました S1.
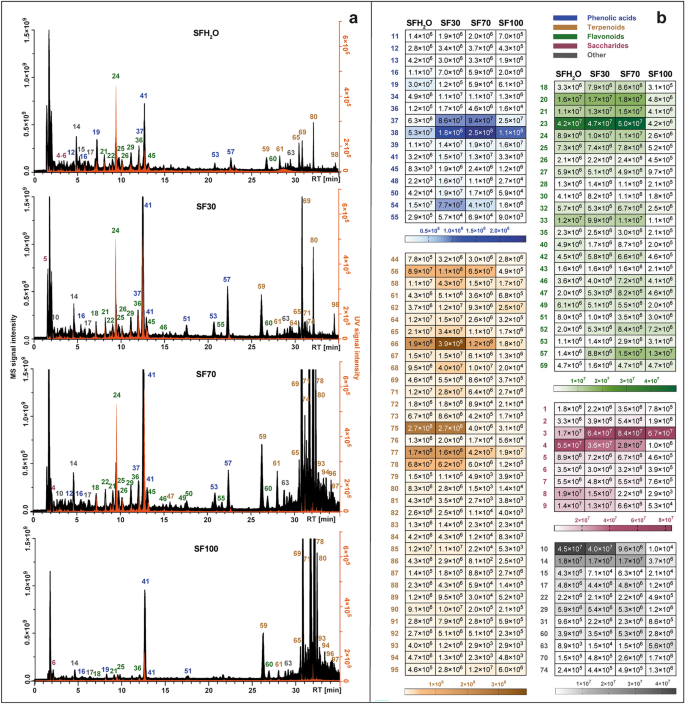
各抽出物の代謝プロファイルを並べて図に示します。 1a. 抽出液の種類によって、優勢なグループは変化した。主に水を含む溶媒(SFH)で抽出したサンプルでは、優勢なグループは変化しなかった。2OおよびSF30)で最も豊富な化合物はフェノール酸でした。テルペノイド化合物の抽出効率は、これらの化合物の非極性の性質により、使用した溶媒中のエタノールの増加と一致していました。さらに、4つの異なる植物化学物質で検出された個々の植物化学物質の信号強度のヒートマップが示されました。 S.フルティコサ 抜粋を図に示します。 1b.研究された抽出物で検出された最も多くの種類の化合物はテルペノイドの 35 化合物で、続いてフラボノイド (24 化合物)、フェノール酸および誘導体 (19 化合物)、糖類 (9 化合物)、脂肪酸、カルボン酸、未確認化合物などでした。 。
ネガティブ モードの LC-Q-Orbitrap によって取得されたトータル イオン クロマトグラム (黒) と、270 nm で UV-Vis 検出器によって記録されたクロマトグラム (オレンジ) を組み合わせたものある)、4つの異なるスペクトルにおける同定された化合物の平均MSピーク面積値を表すヒートマップが設定されている。 S.フルティコサ 抜粋: SFH2O – 水抽出物。 SF30-30% エタノール抽出物; SF70-70% エタノール抽出物; SF100 – エタノール抽出物 (b)。ピークの正体については、補足表を参照してください。 S1.
2 つの最も極性の高い抽出物 (SFH) の場合2OおよびSF30)では、フェノール酸がピーク面積全体で最も豊富なクラスであった。このクラスは主にカフェ酸誘導体によって代表された。化合物の保持時間(RT)は 16 前駆体イオン [MH] ̄ を使用 メートル/秒 179.03419 はコーヒー酸標準の RT と一致していました。また、特徴的な主要フラグメントも生成されました。 メートル/秒 135.04414、二酸化炭素の損失による。化合物中に脱プロトン化された形のコーヒー酸が検出されました 40 そして 41、サゲリン酸([MH]¯)であると同定された。 メートル/秒 719.16210) およびロズマリン酸 ([MH] ̄ at) メートル/秒 359.0773)。ロズマリン酸の同定は、標準物質との比較によってさらに確認された。同じイオンまたはその損失が、化合物で観察された。 20, 37, 39, 44, 53, 57 そして 58、文献および MS との比較によって裏付けられました。2 断片化はサルビアフラシド([MH]¯)として同定された。 メートル/秒 521.13012)、サルビアノール酸B([MH]¯ at メートル/秒 717.14661)、イソサルビアノール酸B([MH]¯ at メートル/秒 717.14667)、サルビアノール酸 K ([MH] ̄ at メートル/秒 555.11469)、2 つのサルビアノール酸 F 異性体 ([MH] ̄ at メートル/秒 313.07205)およびサルビアノール酸C([MH]¯ at メートル/秒 491.09863).
最も非極性の 2 つの抽出物 (SF70、SF100) の場合、テルペノイドの寄与が最も高かったが、残りの抽出物では、このクラスは、特定された化合物のピーク面積の合計の約 4 分の 1 を占めた。このクラスは主にジテルペノイドによって表され、研究された抽出物で特定された最も多様な非極性クラスの化合物であった。それらは主にアビエタン型ジテルペノイドであり、負イオン化による断片化には、多くの場合 CO の除去が含まれる。2 (-44 Da)、CO (-28 Da)、H2O (-18 Da)、·CH3 (15Da)。化合物 59 ([MH] ̄ で メートル/秒 345.17075)および 64 ([MH] ̄ で メートル/秒 345.17100)は両方とも二酸化炭素分子の損失に起因するイオンを示した(メートル/秒 301.18097) と水分子 (メートル/秒 283.17038 および メートル/秒 283.17041)、ロスマノールおよびエピイソロスマノールとして同定されました。コンパウンド 69 ([MH] ̄ で メートル/秒 329.17580)は、二酸化炭素の損失から始まる典型的な断片化パターンに基づいてカルノソルであると特定されました(メートル/秒 285.16604)12,15 続いてメチルラジカル(メートル/秒 270.16211)。同じ断片化パターンが化合物 80, 12-メトキシカルノシン酸 ([MH] ̄ として同定される) メートル/秒 345.20721)と301.21689および286.19385の断片からなる化合物。 78、擬似分子イオンを含む メートル/秒 331.19153 [MH]¯は、二酸化炭素の喪失とそれに続くイソプロピルラジカルの喪失に対応するフラグメントの存在により、カルノシン酸であると同定された(メートル/秒 287.20175 および 244.14687)。コンパウンド 70 [MH]¯で前駆イオンを示した メートル/秒 343.15524、特徴的なフラグメントを生成 メートル/秒 315.16028 および メートル/秒 それぞれエチレンと二酸化炭素の損失により299.160504。それにより化合物を特定できるようになります 70 ロスマジアルとして。試験した抽出物には、2つの五環式トリテルペノイドも検出された:化合物 96 そして 97、これらは暫定的にそれぞれベツリン酸とウルソール酸として同定され、([MH] ̄ で準分子イオンを持つ) メートル/秒 455.35340)。これらのトリテルペノイドの存在は、次の文献でも報告されています。 S.フルティコサ Jash らによる16.
研究された抽出物、特に水分含有量の高い抽出物 (SFH)2O、SF30)、同定された化合物の総ピーク面積におけるオリゴ糖と糖酸の大きな割合も確認された。化合物 1, 2 そして 3 スタキオース、ラフィノース、スクロースと暫定的に同定されたが、これらはしばしば主要な輸送糖である。 サルビア 種31. 化合物 4~8歳 糖酸として分類された。化合物の断片化パターン 6 ([MH] ̄ で メートル/秒 135.02875)は、 l-トレオン酸。化合物 8 ([MH] ̄ で メートル/秒 149.0081) 生成されたフラグメント メートル/秒 72.99171、59.01249、および 87.00734 は、マイナスイオン化モードで観察できます。 l-(+)-酒石酸。
検出された植物化学物質のもう一つの主要なクラスは S.フルティコサ 抽出物はフラボノイドでした。このクラスに属する化合物のほとんどはフラボンに割り当てられています。化合物 24 保持時間、UVスペクトル、MS/MSフラグメンテーションパターンを市販の標準物質と比較することで、スクテラリンであることが明確に確認されました。化合物 46 そして 55 でほぼ同じ前駆体イオン [MH] ̄ を示しました。 メートル/秒 299.0563 と 299.0562。コンパウンド 46 で最も豊富なフラグメントが生成されました メートル/秒 284.03253と136.98682、同様に複合 55。これらのデータは、ヒスピドゥリンまたはジオスメチンの断片化パターンと一致します。保持時間に違いがあるため、両方の化合物が存在する可能性があります。 S.フルティコサ 抜粋します。コンパウンド 49 [MH]¯で前駆イオンを示した メートル/秒 285.04065は、特定の生成物イオンを形成した。 メートル/秒 133.02834、151.00261、175.03903、Velamuriらによってルテオリンについて報告されたものと一致しています。17. 複合語 52 ([MH] ̄ で メートル/秒 327.21786)は、このフラボンが以前に報告されているため、サルビゲニン(ペクトリナリゲニン-7-メチルエーテル)として同定されました。 S.フルティコサ. 複合語 54 ベースピーク[MH]¯は メートル/秒 269.04578. 前駆体イオンと生成物イオン メートル/秒 117.03332 および 151.00264 により、この化合物がアピゲニンであることが確認されました。コンパウンド 56 前駆体イオン[MH]¯を メートル/秒 329.0668、その分子式は C であることを示します17H14○7。それは顕著なフラグメントイオンを生成しました メートル/秒 299.01981は2つのメチル基の喪失に起因し、271.02472は一酸化炭素のさらなる除去に起因します。したがって、このピークはジャセオシジンであると特定されました。化合物 60 前駆イオン[MH]¯に基づいてシスマリチンと同定された。 メートル/秒 313.07190 および診断製品イオンは次のとおりです。 メートル/秒 298.04694 と 283.02478 は、一酸化炭素の除去による 2 つのメチルラジカルと 255.02974 の損失を示します。コンパウンド 62 ([MH] ̄ で メートル/秒 283.06137)は、アピゲニン誘導体に相当する。 メートル/秒 268.03772 および 117.03318。特徴的なフラグメントイオン メートル/秒 240.04193は一酸化炭素の損失により形成され、化合物が生成される 62 ゲンクワニンと同定されました。アピゲニン、ヒスピドリン、シルシマリチン、ゲンクワニンの断片化パターンは、Koutsoulas らによって報告されたものと一致しました。12. 複合語 50 研究された抽出物で検出された唯一の種類のフラボノール アグリコンでした。プリカーサーイオン [MH] ̄ を使用すると、 メートル/秒 315.0513 および主要な MS/MS フラグメントは次のとおりです。 メートル/秒 メチル基の喪失から生じる 300.02756 から、この化合物はイソラムネチンとして同定されました。コンパウンド 30 擬似分子イオン [MH] ̄ を使用して メートル/秒 609.18329 では断片化は見られませんでしたが、以前に報告されていたため、 S.フルティコサ18,19、それは暫定的にフラバノンヘスペリジンであると同定された。この研究で発見されたフラボノイド配糖体は、主に162 Daの特徴的なフラグメントを持つ配糖体、グルクロニド(176 Da)、およびルチノシド(308 Da)であった。ルテオリン配糖体(化合物 22 [MH]¯で メートル/秒 447.09344) の化学組成に関するほとんどの出版物に記載されています。 S.フルティコサ 抜粋12,18,19,20,21. 複合語 26 で前駆体イオン [MH] ̄ を示しました。 メートル/秒 491.0836であり、イソラムネチングルクロニドとして同定され、以前に報告された。 S.フルティコサ Gürbüzらによるもののみ。22. 複合語 27 ([MH] ̄で メートル/秒 577.15668)、アピゲニン-ルチノシドとして同定されたものは、Cvetkovikらによってギリシャのセージからも発見されました。21.
脂肪酸の存在も観察された。 S.フルティコサ 抽出物。化合物 63 そして 73 暫定的に 2 つの多価不飽和脂肪酸として同定されました。コンパウンド 63 ジヒドロキシオクタデカジエン酸(C18H31○4 ̄)。コンパウンド 73 前駆体イオン [MH] ̄ が生成されました。 メートル/秒 295.22803 と特徴的な断片 メートル/z 277.21738 ([MHH2O]− および 195.13837 [M-(CHO-(CH2)4-CH3)-H] ̄、炭素原子 13 番目のヒドロキシル基の位置を示します。したがって、それは 13-ヒドロキシ-9,11-オクタデカジエン酸であると同定されました。また、 S.フルティコサ ツベロン酸のグルコシドの存在を抽出します (メートル/秒 387.16644) (複合 14)成長ホルモンであることが観察されました。
主要な植物化学物質の定量分析
さまざまな抽出物中の主なフェノール化合物の定量化 S.フルティコサ 植物材料の乾燥重量(mg/g DW)を表に示します。 1。コーヒー酸、スクテラリン、サルビアノール酸 B、ロスマリン酸、カルノシン酸、およびカルノソールの含有量は、本物の標準の検量線に基づいて計算され、他の化合物の含有量は、最も類似した入手可能な標準との関係で推定されました。
全体として、セージ抽出物に最も豊富に含まれる化合物はロズマリン酸で、これはフェノール酸であり、カフェ酸の二量体です。試験したすべてのサンプルの中で最高のロズマリン酸濃度は SF70 (31.56 ± 1.88 mg/g DW) で見つかりました。これは、SF70 のロズマリン酸濃度と同様です。 S.フルティコサ クロアチアから採取された(29.10 ± 0.21 mg/g DW)、Mervić et al. によって報告された。23Sarrou らが研究したギリシャ産セージのメタノール抽出物では、さらに高い含有量 (60.73 mg/g DW) が報告されました。19しかし、この研究では溶媒として純粋なアルコールを使用しても、最高のロスマリン酸収率は得られませんでした。輸液中のロズマリン酸濃度(SFH)2O)は他の抽出物よりもはるかに低い(4.96±0.65mg/g DW)が、これはトルコ産の品種で行われた同様の比較の結果と一致しない。 S.フルティコサ テキン著18。コーヒー酸は、研究したすべての抽出物からも同様の濃度(0.13~0.15 mg/g DW)で検出されましたが、これは Mervić らの報告よりも 10 分の 1 低かったです。23。しかし、セージ植物の主要なカフェ酸由来三量体に属するサルビアノール酸は、より多量に存在するものはほとんどありませんでした。最高濃度のサルビアノール酸 B は、SF70 および SF30 抽出物で得られました (6.86 ± 0.93 mg/g DW および 6.52 ± 0.48 mg/g DW)。サルビアノール酸 K は ST30 抽出物中に最も豊富で、濃度は 6.25 ± 1.0 mg/g DW でした。 Cvetkovikらによって提示されたデータによると、21、研究されたギリシャのいくつかの集団におけるサルビアノール酸Kの最高濃度は、 S.フルティコサ 7.20mg/gDWであった。
最も豊富なテルペノイド化合物 S.フルティコサ カルノシン酸とカルノソールは、どちらもアビエタンジテルペノイドのファミリーに属します。12カルノシン酸の含有量が最も高かったのは SF100 (14.82 ± 1.66 mg/g DW) で、次いで SF70 (13.88 ± 2.52 mg/g DW) で、統計的に差はありませんでした。これらの結果は、Kallimanis らによるメタノール抽出物中の含有量の測定結果と一致しています。24 これは 12.5 ± 1.6 mg/g DW でした。SF70 抽出物中のカルノソールの量は 7.88 ± 1.33 mg/g DW であり、Sarrou らによって報告された量と一致しました。19研究された抽出物の中で3番目に豊富なテルペノイドであるサルビオールは、アビエタンジテルペノイドであるフェルギノールから誘導されたメロテルペノイドであり、例えば他のギリシャのセージ種によく見られます。 S.ポミフェラ25この化合物は、 S.フルティコサ;しかし、それは研究された抽出物のほとんどに存在し、最高含量:SF70 で 7.37 ± 0.71 mg/g DW でした。
で検出された生物活性物質の 3 番目のグループ S.フルティコサ 抽出物はフラボノイドでした。スクテラリンはセージに含まれる一般的なフラボノイドの 1 つです26研究対象抽出物中で最も豊富なフラボノイドであり、SFHでは7.77 ± 0.48 mg/g DW、8.92 ± 1.56 mg/g DW、7.35 ± 0.9 mg/g DWと、同様の収量であった。2それぞれO、SF30、SF70抽出物。ルテオリン ルチノシドとルテオリングルコシドの濃度は、研究したすべての抽出物で同様で、1.03 ~ 1.98 mg/g DW の範囲でしたが、これは Tekin らによって報告されたデータとは一致しません。18ここで、セージ注入中のこれらの化合物の濃度は、エタノール抽出物中の濃度よりも 2 ~ 3 倍高かった。
フェノール酸、フラボノイド、テルペノイドは、代表的な生理活性化合物です。 S.フルティコサ表に示すように 1、抽出収率は溶媒中のエタノール含有量に大きく影響されました。水のみによる抽出とは対照的に、70% エタノールによる抽出では、生物活性物質の総収量が最も高くなりました。違いはフェノール酸とテルペノイドの収率にはっきりと現れており、SF70 ではそれぞれ 3 倍、7 倍高かった。フラボノイドの最大抽出収量は 30% エタノールで得られましたが、70% エタノールで得られた収量よりもわずかに高いだけでした。研究された生物活性物質のすべてのグループを考慮すると、70% エタノールが、生物活性化合物の抽出について試験された溶媒の中で最良の溶媒であると結論付けられます。 S.フルティコサ.
抗酸化作用
植物材料中に抗酸化活性を示す化合物の存在は、その健康増進特性を定義する重要な側面となっています。さまざまな種類のセージの場合、その高い抗酸化活性は主にフェノール化合物によって引き起こされます。提示された研究では、総抗酸化活性は次のように決定されました。 S.フルティコサ 異なる極性の抽出剤で調製した抽出物。さらに、セージに典型的で、フェノール酸、フラボン、ジテルペノイドなどのさまざまなクラスの二次代謝産物に属する特定のフェノール化合物の抗酸化活性を測定しました。
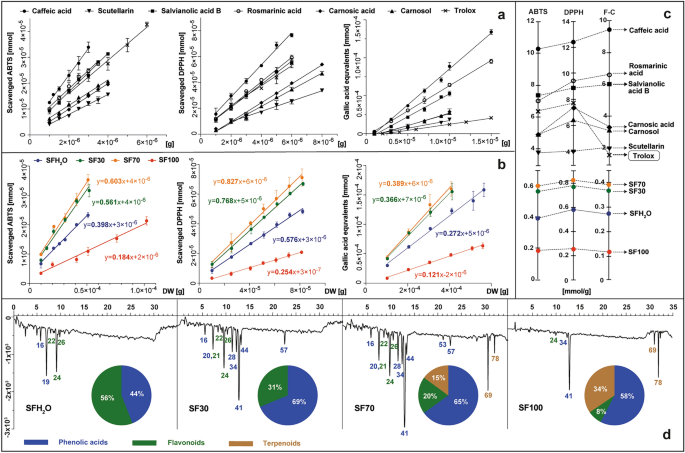
本研究では、ABTS、DPPH、Folin-Ciocalteu(F-C)試薬を使用した3つの最も一般的な分光光度計による試験結果を比較しました。ABTSとDPPHアッセイは、純粋化合物と同様に、抽出物のフリーラジカル消去活性を測定するために広く使用されています。 S.フルティコサ 抽出物の場合、計算された抗酸化活性は、反応開始から 10 分後に乾燥物質 1 g から得られた抗酸化物質によって還元された ABTS または DPPH 分子の数を表します。これらの値は、方法の直線範囲で計算され、還元された酸化剤のミリモル数と、反応混合物中の乾燥物質のグラム数として表されるさまざまな量の試験サンプルとの関係を表す直線の傾きとして表されます (図 1)。 2b)。
標準物質(カフェ酸、スクテラリン、サルビアノール酸 B、ロスマリン酸、カルノシン酸、カルノソール、トロロックス)の抗酸化活性と S.フルティコサ 抜粋: SFH2O–水抽出物、SF30–30%エタノール抽出物、SF70–70%エタノール抽出物、SF100–エタノール抽出物をABTS、DPPH、F–C試薬で試験し、試験した標準品で減じた試薬の依存曲線を示すプロットとして提示(ある) または抽出 (b) であり、試薬のミリモル数を試験サンプル 1 g で減じた値に等しい曲線の傾きとして表されます (c) ABTS によるポストカラム誘導体化後に 734 nm で登録された抽出物の抗酸化物質プロファイルを設定し、抗酸化物質の主要なクラスを円グラフに示します (d)。ピークの正体については、補足表を参照してください。 S1.
この研究には、フォリン・チオカルト試薬を用いた方法も含まれています。これは、アルカリ性環境下で、活性ヒドロキシル基を持つ化合物からリンモリブデン・リンタングステン酸錯体への電子の移動です。この場合の還元能力は、植物の乾燥物 1 g から得られる青色錯体を形成する没食子酸当量のミリモル数として表されました。同じアプローチが、セージに含まれるカフェ酸、カルノシン酸、カルノソール、サルビアノール酸 B、スクテラリン、ロスマリン酸、さらに参照抗酸化物質であるトロロックスなどの特定の純粋物質にも使用されました (図 1)。 2a) 植物材料および純物質の抗酸化活性を決定および計算するこのような方法は、以前に Kusznierewicz らによって説明されました。27 およびBaranowskaら。28得られた傾きの値は、標準およびサンプルに対して実施された各テストごとに別々の軸にプロットされました (図 1)。 2c) 試験したフェノール標準物質はいずれも抗酸化活性を示し、その活性はスクテラリン < カルノソール < カルノシン酸 < サルビアノール酸 B < ロスマリン酸 < カフェ酸の順であった。そのうち 3 つ (サルビアノール酸 B、ロスマリン酸、カフェ酸) は、抗酸化活性測定アッセイで一般的に参照として使用される化合物であるトロロックスよりも効果的であった。試験したすべてのフェノール抽出物の抗酸化活性は、 S.フルティコサ は、ABTS アッセイおよび DPPH テストにおいて用量依存性でした。したがって、反応混合物に添加される抽出物の量が増加すると、これらのラジカルに対する還元力も増加します。総抗酸化活性はSF100抽出物で最も低く、次いでSFHではほぼ2倍高く観察されました。2O では、SF30 と SF70 ではほぼ 4 倍高くなりました。F-C テストの結果は、ABTS および DPPH と同じ傾向を示し、ピアソン相関は 0.99 でした。これは、Lantzouraki らによって実証されているように、抽出物の抗酸化活性はフェノール含有量に大きく依存することを示しています。29.
抽出物中の試験対象として選ばれた6つの植物化学物質の含有量に基づいて(表 1)およびそれらおよび抽出物について決定された抗酸化活性(図2)。 2a、c)では、これらの化合物が個々の抽出物の総抗酸化活性にどの程度寄与しているかを推定することができる。SFHの場合2O、SF30、SF70 抽出物では、試験に応じて 6 つの選択された化合物が、理論的には、決定された総抗酸化活性のそれぞれ 21~30%、45~63%、64~86% をカバーしました。これらの結果は、これらの抽出物に他の追加の抗酸化物質が存在する可能性があること、および/またはそれらの相乗効果があることを示唆しています。SF100 抽出物の場合のみ、6 つの標準化合物の活性の合計が、使用した試験に応じて 20~49% の範囲のこの抽出物の決定された総活性を超えました。このような観察は、この種の抽出物に存在する植物化学物質間の拮抗的な相互作用の結果である可能性があります。
テストされた製品に含まれる抗酸化物質の種類に関する詳細情報 S.フルティコサ 抽出物は、ABTS 試薬を使用した HPLC ポストカラム誘導体化を使用して得られました。この方法で得られた抗酸化物質のプロファイルと、総抗酸化活性におけるさまざまな種類の抗酸化物質の寄与を図に示します。 2d. 先にテストした6つの標準的な抗酸化物質に加えて、 S.フルティコサ 抽出物には、プルゼワルスキン酸 A、サルビアフラシド、ルテオリン ルチノシド、ルテオリングルコシド、イソラムネチン グルクロニド、クマロイル カフェオイルグリコシド、サルビアノール酸 K、サルビアノール酸 F などの他の抗酸化物質も含まれていました。 ABTS ラジカルは SF70 および SF30 抽出物で観察されました。これら 2 つのサンプルの抗酸化プロファイルは類似しているにもかかわらず、共通のシグナルの強度は SF70 の方が高く、ジテルペノイドに由来する追加の活性も認められました。 SF70 および SF100 抽出物のプロファイルでのみ、ジテルペノイドに由来する負のピークが観察され、それぞれ 15 および 34% での総抗ラジカル活性におけるそれらのシェアが認められました。エタノールを含むすべての抽出物に含まれる主な抗酸化物質はロズマリン酸でした。ロズマリン酸は最も豊富なフェノール酸であり、研究された標準物質の中で最も強力な抗酸化物質の 1 つです。についても同様の結果が報告されました S. オフィシナリス そして S.ヒスパニカ 抜粋30,31.
水性抽出物 (SFH)2O) 抗酸化活性は主に 2 つの化合物、すなわちプレワルスキニン酸 A とスクテラリンに由来しており、水のみによるロスマリン酸の抽出では効果が低かった。
キサンチンオキシダーゼ阻害活性
キサンチンオキシダーゼ (XO) 酵素は、ヒポキサンチンとキサンチンを尿酸に酸化する触媒作用をします。尿酸が血液中に過剰になると痛風を発症します。XO の再酸化中、分子酸素は電子受容体として働き、スーパーオキシドラジカルと過酸化水素を生成します。その結果、XO はスーパーオキシドラジカルの重要な生物学的発生源であると考えられており、他の活性酸素種とともに体内の酸化ストレスに寄与し、炎症、アテローム性動脈硬化症、癌、老化など多くの病理学的プロセスに関与しています。32最近の高尿酸血症治療のアプローチは、XO酵素を阻害することです。XO阻害剤(アロプリノール、フェブキソスタット)を含むさまざまな薬剤が開発されていますが、残念ながらその使用には特定の副作用が伴います。このため、これらの合成化合物の代替となる天然のXO阻害剤が絶えず探されています。文献には、いくつかの種のXO阻害剤の能力に関する報告があります。 サルビア (S. plebeia、S. miltiorrhiza、S. verbenaca)XOを阻害する33,34,35したがって、この活動の発生の可能性も研究対象でテストされました。 S.フルティコサ 抜粋します。さらに、カフェ酸、カルノシン酸、カルノソール、サルビアノール酸 B、スクテラリン、ロズマリン酸、さらに参考までに、XO 阻害剤アロプリノールなど、セージに典型的な選択されたフェノール化合物でも XO 阻害活性が測定されました。
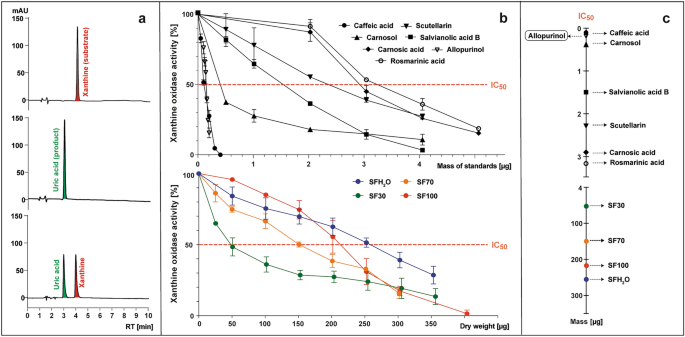
試験サンプルの存在の有無にかかわらず、XO によるキサンチン (基質) から尿酸 (生成物) への変換を、285 nm で HPLC-PAD を使用してモニタリングしました (図 1)。 3a)。酵素活性は、サンプルを添加しない対照と比較した、試験サンプルの存在下で形成された尿酸ピーク面積のパーセンテージとして計算されました(図1)。 3b) XO酵素の阻害はIC50 値は、酵素活性を 50% まで低下させることができるサンプルの標準重量または乾燥重量 (μg) の質量を意味します (図 3紀元前)。
以下を含む反応後混合物の 285 nm での HPLC クロマトグラムの例 (上から): キサンチン;キサンチンおよびキサンチンオキシダーゼ (XO);キサンチン、XO および阻害剤 (ある)、これは、試験された標準物質(カフェ酸、スクテラリン、サルビアノール酸B、ロスマリン酸、カルノシン酸、カルノソール、アロプリノール)の存在下でのXO活性の曲線を表すプロットを作成するための基礎となった。 S.フルティコサ 抽出物(SFH2O–水抽出物; SF30–30%エタノール抽出物; SF70–70%エタノール抽出物; SF100 –エタノール抽出物) (b)、パラメータ IC を決定するために使用されました。50, つまり、XO活性を50%に低下させるために必要な試験サンプルのマイクログラム数(c).
既知の XO 阻害剤アロプリノールを基準として使用し、IC を使用しました。50 0.15μg(5.5μM)の値であった。試験したすべての標準物質は、IC50 0.1 ~ 3.15 μg (2.8 ~ 43.8 μM) の範囲です。 XO阻害活性は、ロスマリン酸 < カルノシン酸 < スクテラリン < サルビアノール酸 B < カルノソール < カフェ酸の順に増加しました。コーヒー酸は最も低いICを示しました50 値 (0.1 μg; 2.8 μM) は、試験した化合物の中で最も強い XO 阻害活性を示します。それはアロプリノールよりもさらに強力でしたが、これはWanらによって提示されたデータと一致しません。36 およびFlemmigら。37、IC50 カフェ酸の濃度は、それぞれアロプリノールのほぼ 8 分の 1 または 2 分の 1 でした。これらの違いは、テスト用に選択された XO の起源に起因する可能性があります。引用された研究では牛乳由来のオキシダーゼが使用されましたが、この研究では微生物オキシダーゼが選択されました。この研究では、ロズマリン酸の XO 阻害力が最も低かった (3.2 μg; 43.8 μM) が、Ghallab et al.38 アロプリノールとロスマリン酸の相乗的な組み合わせにより、必要な合成薬物の投与量を減らすことができると報告しました。 XOは研究されたすべての物質で阻害された S.フルティコサ 抽出物は、アロプリノールよりも1000倍以上効果が低いが、他の研究で報告されたデータと一致している。 サルビア スクテラリンと他のフラボンは、XOの強力な阻害剤として以前に説明されている。39。 SF30 抽出物と SF70 抽出物の総フラボノイド含有量にはわずかな違いがあり、他の抗炎症化合物の含有量は SF70 抽出物の方が有利であるにもかかわらず、SF30 は XO 活性を阻害する最も強力な能力を持っていました。 IC50 SF30 の値は 50 μg であり、このパラメーターに基づいて、SF70、SF100、および SFH の潜在的な抗炎症活性が決まりました。2O 抽出物はそれぞれ 3、4、5 倍弱いことが判明しました。
[ad_2]