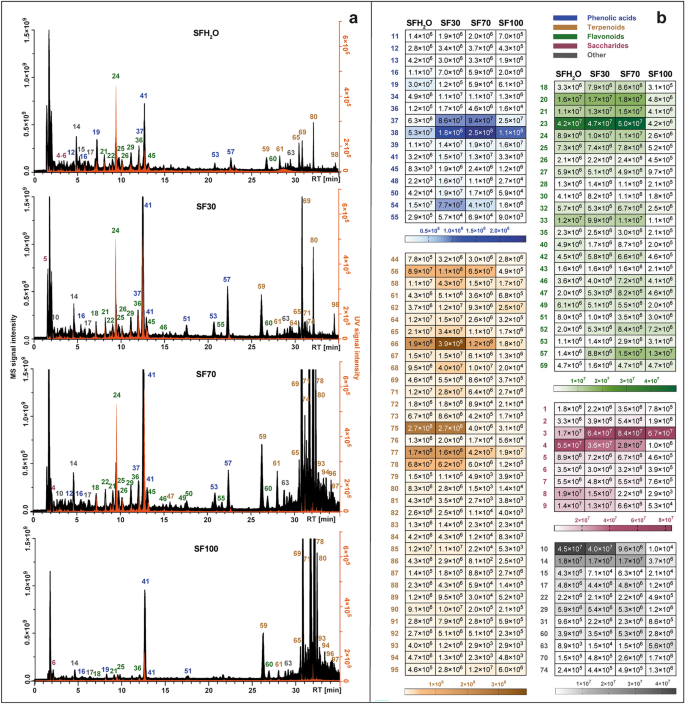
Profilage métabolomique à l'aide de LC-Q-Orbitrap HRMS
En général, les études métabolomiques sur Salvia les espèces en mode d'ionisation négatif ont tendance à être plus efficaces que celles en mode positif15. Dans cette étude, l'analyse des données MS comprenait l'utilisation de bases de données en ligne et locales fournies par le logiciel Compound Discoverer 2.1. De plus, les données recueillies lors d'études métabolomiques antérieures sur Salvia les espèces ont été collectées et fusionnées dans une liste de masse à mettre en œuvre en tant que base de données locale. Au total, 2 704 pics de substances ont été détectés S. fruticosa extraits en analyse en mode ions négatifs. Après avoir filtré les signaux mineurs (Zone < 104), il y avait 98 métabolites, dont 95 ont été provisoirement identifiés, comme le montre le tableau supplémentaire. S1.
Les profils métaboliques de chaque extrait ont été juxtaposés et présentés sur la Fig. 1un. Les groupes dominants ont changé selon les différents extraits. Dans ceux obtenus avec des solvants contenant majoritairement de l'eau (SFH2O et SF30), les composés les plus abondants étaient les acides phénoliques. L’efficacité d’extraction des composés terpénoïdes était cohérente avec l’augmentation de l’éthanol dans le solvant utilisé en raison de la nature non polaire de ces composés. De plus, une carte thermique avec l'intensité du signal des composés phytochimiques individuels détectée dans quatre différents S. fruticosa des extraits sont présentés dans la Fig. 1b. La classe de composés la plus nombreuse détectée dans les extraits étudiés était celle des terpénoïdes avec 35 composés, suivis des flavonoïdes (24 composés), des acides phénoliques et dérivés (19 composés), des saccharides (9 composés) et d'autres tels que les acides gras, les acides carboxyliques et les composés non identifiés. .
Chromatogrammes d'ions totaux obtenus par LC-Q-Orbitrap en mode négatif (noir) combinés avec des chromatogrammes enregistrés par le détecteur UV-Vis à 270 nm (orange) (un), défini avec une carte thermique représentant la valeur moyenne de la surface du pic MS des composés identifiés dans quatre différents S. fruticosa extraits : SFH2Extrait O-eau; Extrait éthanolique SF30-30% ; Extrait éthanolique SF70-70% ; Extrait SF100-éthanol (b). Pour l'identité des pics, voir le tableau supplémentaire S1.
Dans le cas de deux extraits les plus polaires (SFH2O et SF30), les acides phénoliques étaient les classes les plus abondantes dans la surface totale du pic. Cette classe était représentée principalement par les dérivés de l'acide caféique. Le temps de rétention (RT) du composé 16 avec l'ion précurseur [MH]¯ à m/z 179.03419 était conforme à la RT de la norme sur l'acide caféique. Il a également généré un fragment majeur caractéristique à m/z 135.04414, en raison de la perte de dioxyde de carbone. La forme déprotonée de l'acide caféique a été détectée dans des composés 40 et 41, qui ont été identifiés comme étant l'acide sagerinique ([MH]¯ à m/z 719.16210) et l'acide rosmarinique ([MH]¯ à m/z 359.0773). L'identification de l'acide rosmarinique a en outre été confirmée par comparaison avec l'étalon. Le même ion ou sa perte avait été observé pour les composés 20, 37, 39, 44, 53, 57 et 58, qui a été étayé par une comparaison avec la littérature et MS2 fragmentation, ont été identifiés comme étant du salviaflaside ([MH]¯ m/z 521.13012), acide salvianolique B ([MH]¯ à m/z 717.14661), acide isosalvianolique B ([MH]¯ à m/z 717.14667), acide salvianolique K ([MH]¯ à m/z 555.11469), deux isomères F de l'acide salvianolique ([MH]¯ à m/z 313.07205) et l'acide salvianolique C ([MH]¯ à m/z 491.09863).
Dans le cas des deux extraits les plus apolaires (SF70, SF100), la contribution des terpénoïdes était la plus élevée, tandis que dans les extraits restants, cette classe représentait environ un quart de la somme de la surface des pics des composés identifiés. Cette classe était représentée principalement par les diterpénoïdes, qui constituaient la classe de composés non polaires la plus variée identifiée dans les extraits étudiés. Il s'agissait pour la plupart de diterpénoïdes de type abietane, pour lesquels la fragmentation par ionisation négative incluait souvent l'élimination du CO2 (-44 Da), CO (-28 Da), H2O (-18 Da),·CH3 (15 jours). Composés 59 ([MH]¯ à m/z 345.17075) et 64 ([MH]¯ à m/z 345.17100) affichaient tous deux des ions attribuables à la perte de molécule de dioxyde de carbone (m/z 301.18097) et molécule d'eau (m/z 283.17038 et m/z 283.17041), et ont été identifiés comme étant le rosmanol et l'épiisorosmanol. Composé 69 ([MH]¯ à m/z 329.17580) a été identifié comme étant du carnosol sur la base de son schéma de fragmentation typique, commençant par la perte de dioxyde de carbone (m/z 285.16604)12,15 et suivi de l'élimination d'un radical méthyle (m/z 270.16211). Le même schéma de fragmentation s'est produit dans le complexe 80, identifié comme étant l'acide 12-métoxy carnosique ([MH]¯ à m/z 345.20721) avec des fragments de 301.21689 et 286.19385. Composé 78, avec un ion pseudomoléculaire à m/z 331.19153 [MH]¯ a été identifié comme acide carnosique en raison de la présence de fragments correspondant à la perte de dioxyde de carbone et à la perte ultérieure d'un radical isopropyle (m/z 287.20175 et 244.14687). Composé 70 a montré un ion précurseur à [MH]¯ à m/z 343.15524, qui a généré des fragments caractéristiques m/z 315.16028 et m/z 299.160504 via la perte d'éthylène et de dioxyde de carbone, respectivement. Cela nous permet d'identifier le composé 70 comme rosmadial. Deux triterpénoïdes pentacycliques ont également été détectés dans les extraits testés : composé 96 et 97, qui ont été provisoirement identifiés comme étant respectivement l'acide bétulinique et l'acide ursolique, avec des ions quasimoléculaires à ([MH]¯ à m/z 455.35340). La présence de ces triterpénoïdes a également été signalée chez S. fruticosa par Jash et coll.16.
Dans les extraits étudiés, notamment ceux à forte teneur en eau (SFH2O, SF30), une part significative d'oligosaccharides et d'acides sucrés dans la surface totale des pics des composés identifiés a également été notée. Composés 1, 2 et 3 ont été provisoirement identifiés comme étant le stachyose, le raffinose et le saccharose, car ils sont souvent des sucres de transport majeurs dans le Salvia espèces31. Composés 4 à 8 ont été classés comme acides de sucre. Le modèle de fragmentation du composé 6 ([MH]¯ à m/z 135.02875) était identique à celui de je-l'acide thréonique. Composé 8 ([MH]¯ à m/z 149.0081) fragments générés m/z 72.99171, 59.01249 et 87.00734 qui peuvent être observés en mode ionisation négative pour je-( +)-acide tartrique.
Une autre classe majeure de composés phytochimiques détectés dans S. fruticosa Les extraits étaient des flavonoïdes. La plupart des composés identifiés appartenant à cette classe ont été attribués aux flavones. Composé 24 a été identifié sans ambiguïté comme étant la scutellarine en comparant les temps de rétention, les spectres UV et les modèles de fragmentation MS/MS avec ceux de la norme commerciale. Composés 46 et 55 a montré presque les mêmes ions précurseurs [MH]¯ à m/z 299.0563 et 299.0562. Composé 46 a produit les fragments les plus abondants à m/z 284.03253 et 136.98682, composés de la même manière 55. Ces données correspondent au modèle de fragmentation de l'hispiduline ou de la diosmétine. Puisqu’il y avait une différence dans le temps de rétention, les deux composés pourraient être présents dans S. fruticosa extraits. Composé 49 a montré un ion précurseur à [MH]¯ à m/z 285.04065 qui a formé des ions produits spécifiques à m/z 133.02834, 151.00261, 175.03903, conformément à ceux rapportés pour la lutéoline par Velamuri et al.17. Composé 52 ([MH]¯ à m/z 327.21786) a été identifié comme étant la salvigénine (pectolinarigénine-7-méthyléther), car cette flavone a déjà été rapportée dans S. fruticosa. Composé 54 a donné le pic de base [MH]¯ à m/z 269.04578. Ion précurseur et ions produits à m/z 117.03332 et 151.00264 ont confirmé que ce composé est l'apigénine. Composé 56 a donné l'ion précurseur [MH]¯ à m/z 329.0668, indiquant que sa formule moléculaire était C17H14Ô7. Il a produit des fragments d'ions proéminents à m/z 299.01981 attribuable à la perte de deux groupes méthyle, et 271.02472, en raison de l'élimination ultérieure du monoxyde de carbone. Par conséquent, ce pic a été identifié comme étant la jacéosidine. Composé 60 a été identifié comme étant la cisimaritine sur la base d'un ion précurseur [MH]¯ à m/z 313.07190 et les ions du produit de diagnostic à m/z 298.04694 et 283.02478, indiquant la perte de deux radicaux méthyle et 255.02974 provenant de l'élimination du monoxyde de carbone. Composé 62 ([MH]¯ à m/z 283.06137) correspond à un dérivé de l'apigénine en considérant le fragment en m/z 268.03772 et 117.03318. Ion fragment caractéristique à m/z 240.04193 formé par la perte de monoxyde de carbone conduit à un composé 62 étant identifié comme étant genkwanin. Les schémas de fragmentation de l'apigénine, de l'hispiduline, de la cirsimaritine et de la genkwanine étaient cohérents avec ceux rapportés par Koutsoulas et al.12. Composé 50 était le seul type d’aglycone de flavonol détecté dans les extraits étudiés. Avec l'ion précurseur [MH]¯ à m/z 315.0513 et fragment MS/MS principal à m/z 300,02756 résultant de la perte du groupe méthyle, ce composé a été identifié comme étant l'isorhamnétine. Composé 30 avec un ion pseudomoléculaire [MH]¯ à m/z 609.18329 n'a montré aucune fragmentation, mais comme cela a été signalé précédemment dans S. fruticosa18,19, il a été provisoirement identifié comme flavanone-hespéridine. Les glycosides flavonoïdes trouvés dans cette étude étaient principalement des glucosides avec un fragment caractéristique de 162 Da, des glucuronides (176 Da) et des rutinosides (308 Da). Glucoside de lutéoline (composé 22 avec [MH]¯ à m/z 447.09344) est présent dans la plupart des publications concernant la composition chimique du S. fruticosa extraits12,18,19,20,21. Composé 26 a montré un ion précurseur [MH]¯ à m/z 491.0836 et a été identifié comme étant le glucuronide d'isorhamnétine, rapporté plus tôt dans S. fruticosa seulement par Gürbüz et al.22. Composé 27 ([MH]¯ à m/z 577.15668), identifié comme apigénine-rutinoside, a également été trouvé dans la sauge grecque par Cvetkovikj et al.21.
La présence d'acides gras a également été observée dans S. fruticosa extraits. Composés 63 et 73 ont été provisoirement identifiés comme étant deux acides gras polyinsaturés. Composé 63 a été attribué comme acide dihydroxyoctadécadiénoïque (C18H31Ô4¯). Composé 73 produit un ion précurseur [MH]¯ à m/z 295.22803 et fragments caractéristiques à m/z 277.21738 ([MHH2O]− et 195,13837 [M-(CHO-(CH2)4-CH3)-H]¯, indiquant la position du groupe hydroxyle à 13 atomes de carbone. Ainsi, il a été identifié comme étant l’acide 13-hydroxy-9,11-octadécadiénoïque. Aussi dans S. fruticosa extrait la présence du glucoside de l'acide tuberonique (m/z 387.16644) (composé 14) qui est une hormone de croissance, a été observée.
Analyse quantitative des principaux composés phytochimiques
Une quantification des principaux composés phénoliques dans divers extraits de S. fruticosa du poids sec de matière végétale (mg/g DW) est présenté dans le tableau 1. La teneur en acide caféique, scutellarine, acide salvianolique B, acide rosmarinique, acide carnosique et carnosol a été calculée sur la base de courbes d'étalonnage d'étalons authentiques, tandis que la teneur en autres composés a été estimée par rapport à l'étalon disponible le plus similaire.
Dans l’ensemble, le composé le plus abondant dans les extraits de sauge est l’acide rosmarinique, qui est un acide phénolique et un dimère de l’acide caféique. La concentration la plus élevée d'acide rosmarinique parmi tous les échantillons testés a été trouvée dans le SF70 (31,56 ± 1,88 mg/g DW), ce qui correspond à la concentration d'acide rosmarinique dans S. fruticosa collectés en Croatie (29,10 ± 0,21 mg/g DW), rapportés par Mervić et al.23. Une teneur encore plus élevée (60,73 mg/g DW) a été rapportée dans l'extrait méthanolique de la variété grecque de sauge étudiée par Sarrou et al.19, mais dans cette étude, l’utilisation d’alcool pur comme solvant n’a pas entraîné le rendement le plus élevé en acide rosmarinique. Concentration d'acide rosmarinique dans la perfusion (SFH2O) était beaucoup plus faible (4,96 ± 0,65 mg/g DW) que dans d'autres extraits, ce qui ne concorde pas avec les résultats d'une comparaison similaire effectuée pour la variété turque de S. fruticosa par Tekin18. L'acide caféique a également été détecté dans tous les extraits étudiés à des concentrations similaires (0,13 à 0,15 mg/g DW), dix fois inférieures à celles rapportées par Mervić et al.23. Cependant, peu d’acides salvianoliques, qui appartiennent aux principaux trimères dérivés de l’acide caféique dans les plantes de sauge, étaient présents en plus grande quantité. La concentration la plus élevée d'acide salvianolique B a été obtenue dans les extraits SF70 et SF30 (6,86 ± 0,93 mg/g DW et 6,52 ± 0,48 mg/g DW). L'acide salvianolique K était le plus abondant dans l'extrait ST30 avec une concentration de 6,25 ± 1,0 mg/g DW. Selon les données présentées par Cvetkovikj et al.21, la concentration maximale d'acide salvianolique K parmi plusieurs populations grecques étudiées de S. fruticosa était de 7,20 mg/g de poids sec.
Les composés terpénoïdes les plus abondants dans S. fruticosa sont l'acide carnosique et le carnosol, qui appartiennent tous deux à la famille des diterpénoïdes abietane12. La teneur la plus élevée en acide carnosique a été observée dans le SF100 (14,82 ± 1,66 mg/g DW), suivi du SF70 (13,88 ± 2,52 mg/g DW), ce qui n'est pas statistiquement différent. Ces résultats sont en accord avec la teneur mesurée en extrait méthanolique par Kallimanis et al.24 qui était de 12,5 ± 1,6 mg/g de poids sec. La quantité de carnosol dans l'extrait SF70 était de 7,88 ± 1,33 mg/g DW et concordait avec celle rapportée par Sarrou et al.19. Le salviol, le troisième terpénoïde le plus abondant dans les extraits étudiés, est un méroterpénoïde dérivé de l'abiétane diterpénoïde-ferruginol et est commun dans d'autres espèces grecques de sauge, par exemple S. pomifera25. Ce composé n'a pas encore été signalé dans S. fruticosa; cependant, il était présent dans la plupart des extraits étudiés avec la teneur la plus élevée : 7,37 ± 0,71 mg/g DW dans SF70.
Le troisième groupe de bioactifs détectés dans S. fruticosa les extraits étaient des flavonoïdes. La scutellarine est l'un des flavonoïdes courants présents dans la sauge.26. C'était le flavonoïde le plus abondant dans les extraits étudiés avec un rendement similaire : 7,77 ± 0,48 mg/g DW, 8,92 ± 1,56 mg/g DW et 7,35 ± 0,9 mg/g DW dans SFH.2Extraits O, SF30 et SF70, respectivement. Les concentrations de lutéoline rutinoside et de lutéoline glucoside étaient similaires dans tous les extraits étudiés et variaient entre 1,03 et 1,98 mg/g de poids sec, ce qui ne correspond pas aux données rapportées par Tekin et al.18, où les concentrations de ces composés dans les infusions de sauge étaient deux à trois fois plus élevées que dans les extraits à l'éthanol.
Les acides phénoliques, les flavonoïdes et les terpénoïdes sont des composés bioactifs typiques de S. fruticosa. Comme le montre le tableau 1, le rendement de l'extraction était fortement affecté par la teneur en éthanol du solvant. L’extraction avec de l’éthanol 70% a fourni le rendement total le plus élevé en bioactifs, contrairement à l’extraction avec de l’eau uniquement. La différence est clairement visible dans le rendement en acides phénoliques et en terpénoïdes, qui dans le SF70 était respectivement trois fois supérieur et sept fois supérieur. Le rendement d'extraction maximal des flavonoïdes a été obtenu avec l'éthanol 30%, mais il n'était que légèrement supérieur à celui obtenu avec l'éthanol 70%. En considérant tous les groupes de bioactifs étudiés, l'éthanol 70% est considéré comme le meilleur solvant parmi ceux testés pour l'extraction de composés bioactifs de S. fruticosa.
Activité antioxydante
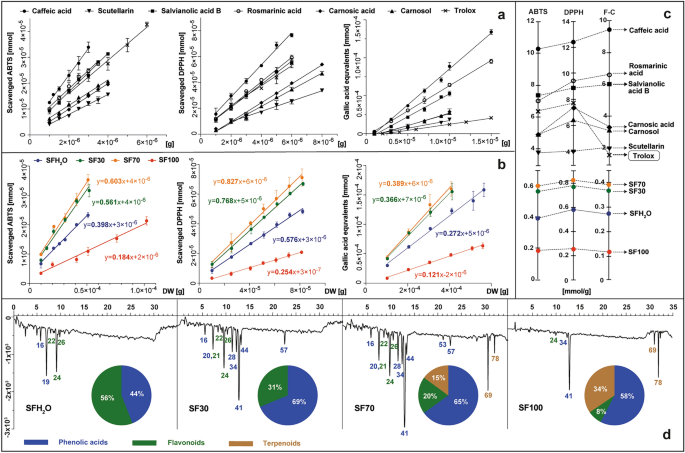
La présence de composés présentant une activité antioxydante dans la matière végétale est devenue un aspect important définissant ses propriétés bénéfiques pour la santé. Dans le cas de diverses espèces de sauge, leur forte activité antioxydante est principalement due à des composés phénoliques. Dans les études présentées, l’activité antioxydante totale a été déterminée pour S. fruticosa extraits préparés avec des extractants de polarité différente. De plus, l’activité antioxydante a été déterminée pour certains composés phénoliques typiques de la sauge et appartenant à diverses classes de métabolites secondaires tels que les acides phénoliques, les flavones et les diterpénoïdes.
L'étude présentée a comparé les résultats des trois tests spectrophotométriques les plus populaires utilisant les réactifs ABTS, DPPH et Folin – Ciocalteu (F – C). Les tests ABTS et DPPH sont largement utilisés pour déterminer l’activité d’élimination des radicaux libres des extraits, tout comme les composés purs. Pour S. fruticosa extraits, l'activité antioxydante calculée décrit le nombre de molécules ABTS ou DPPH réduites par les antioxydants dérivés de 1 g de matière séchée après 10 min de réaction. Ces valeurs ont été calculées dans la plage linéaire de la méthode et exprimées comme la pente de la ligne décrivant la relation entre le nombre de millimoles réduites d'oxydants et diverses quantités d'échantillons testés – en grammes de matière sèche dans les mélanges réactionnels (Fig. 2b).
L'activité antioxydante des standards (acide caféique, scutellarine, acide salvianolique B, acide rosmarinique, acide carnosique, carnosol et trolox) et S. fruticosa extraits : SFH2Extrait O-eau; Extrait éthanolique SF30-30% ; Extrait éthanolique SF70-70% ; Extrait SF100-éthanol, testé in vitro avec les réactifs ABTS, DPPH et F-C présentés sous forme de graphiques montrant les courbes de dépendance du réactif réduit par les normes testées (un) ou des extraits (b) et exprimées en pentes des courbes égales aux milomoles de réactif réduites de 1 g d'échantillon testé (c) défini avec les profils antioxydants des extraits, enregistrés à 734 nm après dérivatisation post-colonne avec ABTS, avec les principales classes d'antioxydants sur les diagrammes circulaires (d). Pour l'identité des pics, voir le tableau supplémentaire S1.
L'étude inclut également la méthode avec le réactif Folin – Ciocalteu. Il consiste en le transfert d'électrons en milieu alcalin de composés comportant des groupes hydroxyles actifs vers des complexes d'acide phosphotungstique phosphomolybdique. La capacité réductrice dans ce cas a été exprimée en nombre de millimoles d’équivalents d’acide gallique, qui formaient un complexe bleu et étaient dérivées de 1 g de matière sèche de la plante. La même approche a été utilisée pour les substances pures sélectionnées présentes dans la sauge, telles que : l'acide caféique, l'acide carnosique, le carnosol, l'acide salvianolique B, la scutellarine, l'acide rosmarinique et en plus pour l'antioxydant de référence, le trolox (Fig. 2un). Une telle méthode de détermination et de calcul de l'activité antioxydante du matériel végétal et des substances pures a été décrite précédemment par Kusznierewicz et al.27 et Baranowska et coll.28, respectivement. Les valeurs de pente résultantes ont été tracées sur des axes distincts pour chaque test effectué pour les étalons et les échantillons (Fig. 2c). Chacun des standards phénoliques testés présentait une activité antioxydante, augmentant dans l'ordre suivant : scutellarine < carnosol < acide carnosique < acide salvianolique B < acide rosmarinique < acide caféique. Trois d’entre eux – l’acide salvianolique B, l’acide rosmarinique et l’acide caféique – se sont révélés plus efficaces que le trolox, un composé couramment utilisé comme référence dans les tests de détermination de l’activité antioxydante. L'activité antioxydante de tous les extraits étudiés de S. fruticosa était dose-dépendant dans le test ABTS ainsi que dans le test DPPH. Par conséquent, à mesure que la quantité d’extrait ajoutée au mélange réactionnel augmente, le pouvoir réducteur envers ces radicaux augmente également. L’activité antioxydante totale la plus faible a été observée pour l’extrait SF100, suivie d’une activité presque deux fois plus élevée pour le SFH.2O, et près de quatre fois plus élevé pour le SF30 et le SF70. Les résultats du test F – C ont suivi la même tendance que ceux de l'ABTS et du DPPH avec une corrélation de Pearson de 0,99, ce qui indique que l'activité antioxydante des extraits dépend fortement de la teneur en composés phénoliques, comme l'ont démontré Lantzouraki et al.29.
Sur la base du contenu de 6 composés phytochimiques sélectionnés pour être testés dans les extraits (tableau 1) et les activités antioxydantes déterminées pour eux et pour les extraits (Fig. 2a,c), nous pouvons déterminer la contribution estimée de ces composés à l’activité antioxydante totale des extraits individuels. Dans le cas de SFH2Extraits O, SF30 et SF70, 6 composés sélectionnés, en fonction du test, couvraient théoriquement respectivement 21 à 301 TP3T, 45 à 631 TP3T et 64 à 861 TP3T de l'activité antioxydante totale déterminée. Ces résultats suggèrent la présence possible d’autres antioxydants supplémentaires dans ces extraits et/ou leurs effets synergiques. Ce n'est que dans le cas de l'extrait SF100 que la somme des activités des 6 composés standards a dépassé l'activité totale déterminée de cet extrait allant de 20 à 49%, selon le test utilisé. Une telle observation pourrait être le résultat d’éventuelles interactions antagonistes entre les composés phytochimiques présents dans ce type d’extrait.
Des informations plus détaillées sur les types d'antioxydants présents dans les produits testés S. fruticosa Les extraits ont été obtenus en utilisant une dérivatisation post-colonne HPLC avec le réactif ABTS. Les profils antioxydants obtenus par cette méthode, ainsi que la contribution des différentes classes d'antioxydants dans l'activité antioxydante totale, sont présentés dans la Fig. 2d. En plus des 6 antioxydants standards testés précédemment, le S. fruticosa les extraits contenaient également d'autres antioxydants tels que l'acide przewalskinique A, le salviaflaside, le rutinoside de lutéoline, le glucoside de lutéoline, le glucuronide d'isorhamnétine, le caféoylglycoside de coumaroyl, l'acide salvianolique K et l'acide salvianolique F. Profils caractérisés par le plus grand nombre et la plus grande taille de pics négatifs indiquant la réduction et la décoloration de Des radicaux ABTS ont été observés pour les extraits SF70 et SF30. Malgré la similitude des profils antioxydants de ces deux échantillons, l'intensité des signaux communs était plus élevée pour le SF70 et une activité supplémentaire provenant des diterpénoïdes a également été remarquée. Ce n'est que dans les profils des extraits SF70 et SF100 que l'on a observé des pics négatifs provenant des diterpénoïdes, avec leur part dans l'activité antiradicalaire totale à 15 et 34%, respectivement. Le principal antioxydant présent dans tous les extraits contenant de l’éthanol était l’acide rosmarinique – l’acide phénolique le plus abondant et l’un des antioxydants les plus puissants parmi les standards étudiés. Le même résultat a également été rapporté pour S. officinalis et S. hispanica extraits30,31.
En extrait aqueux (SFH2O) l'activité antioxydante provenait principalement de deux composés : l'acide przewalskinique A et la scutellarine, car l'extraction de l'acide rosmarinique avec de l'eau seule était moins efficace.
Activité inhibitrice de la xanthine oxydase
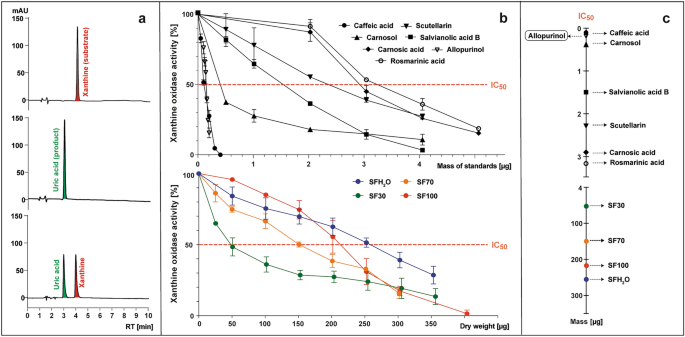
L'enzyme xanthine oxydase (XO) catalyse l'oxydation de l'hypoxanthine et de la xanthine en acide urique, dont un excès dans le sang provoque le développement de la goutte. Lors de la réoxydation XO, l'oxygène moléculaire agit comme un accepteur d'électrons, produisant un radical superoxyde et du peroxyde d'hydrogène. Par conséquent, XO est considéré comme une source biologique importante de radicaux superoxydes qui, avec d'autres espèces réactives de l'oxygène, contribuent au stress oxydatif de l'organisme et sont impliqués dans de nombreux processus pathologiques tels que l'inflammation, l'athérosclérose, le cancer, le vieillissement, etc.32. Une approche thérapeutique récente du traitement de l'hyperuricémie consiste à inhiber l'enzyme XO. Divers médicaments contenant des inhibiteurs de XO (allopurinol, fébuxostat) ont été développés, dont l'utilisation est malheureusement associée à certains effets secondaires. Pour cette raison, on recherche constamment des inhibiteurs naturels de XO qui pourraient constituer une alternative à ces composés synthétiques. Il existe des rapports dans la littérature sur la capacité de plusieurs espèces de Salvia (S. plebeia, S. miltiorrhiza, S. verbenaca) pour inhiber XO33,34,35, par conséquent, l'apparition possible de cette activité a également été testée dans les zones étudiées. S. fruticosa extraits. En outre, l'activité inhibitrice de XO a également été déterminée dans certains composés phénoliques typiques de la sauge, tels que : l'acide caféique, l'acide carnosique, le carnosol, l'acide salvianolique B, la scutellarine, l'acide rosmarinique et en outre, à titre de référence, l'allopurinol, inhibiteur de XO.
La transformation de la xanthine (substrat) en acide urique (produit) par XO avec ou sans la présence d'échantillons testés a été suivie à l'aide de HPLC-PAD à 285 nm (Fig. 3un). L'activité enzymatique a été calculée comme le pourcentage de la surface du pic d'acide urique formé en présence de l'échantillon testé par rapport au contrôle sans ajout de l'échantillon (Fig. 3b). L'inhibition de l'enzyme XO a été exprimée sous forme d'IC50 valeur, c'est-à-dire la masse du poids standard ou sec de l'échantillon (μg) capable de réduire l'activité enzymatique à 50% (Fig. 3avant JC).
Les exemples de chromatogrammes HPLC à 285 nm de mélanges post-réaction contenant (de haut en bas) : xanthine ; la xanthine et la xanthine oxydase (XO); xanthine, XO et inhibiteur (un), qui ont servi de base à la préparation des tracés représentant les courbes d'activité XO en présence des standards testés (acide caféique, scutellarine, acide salvianolique B, acide rosmarinique, acide carnosique, carnosol et allopurinol) ou S. fruticosa extraits (SFH2Extrait O-eau; Extrait éthanolique SF30-30% ; Extrait éthanolique SF70-70% ; SF100 – extrait éthanolique) (b), qui ont été utilisés pour déterminer le paramètre IC50, c'est-à-dire les microgrammes de l'échantillon testé nécessaires pour réduire l'activité XO à 50% (c).
L'allopurinol, un inhibiteur connu de XO, a été utilisé comme référence, avec une CI50 valeur de 0,15 µg (5,5 µM). Tous les standards étudiés ont montré l'activité inhibitrice de XO avec un IC50 allant de 0,1 à 3,15 µg (2,8 à 43,8 µM). L'activité inhibitrice de XO a augmenté dans l'ordre suivant : acide rosmarinique < acide carnosique < scutellarine < acide salvianolique B < carnosol < acide caféique. L'acide caféique a montré la CI la plus basse50 valeur (0,1 µg; 2,8 µM), indiquant la plus forte activité inhibitrice de XO parmi les composés testés. Il était encore plus puissant que l'allopurinol, ce qui est incompatible avec les données présentées par Wan et al.36 et Flemmig et coll.37, où le CI50 de l'acide caféique était respectivement près de 8 ou 2 fois inférieure à celle de l'allopurinol. Ces différences peuvent résulter de l'origine des XO sélectionnés pour les tests. Dans les études citées, une oxydase issue du lait bovin a été utilisée, tandis que pour cette étude, une oxydase microbienne a été sélectionnée. Dans cette étude, l'acide rosmarinique avait le taux d'inhibition le plus faible de XO (3,2 μg ; 43,8 μM), mais Ghallab et al.38 rapporté qu'une combinaison synergique d'allopurinol et d'acide rosmarinique peut réduire la dose de drogues synthétiques nécessaire. XO a été inhibé par toutes les études S. fruticosa extraits, bien que plus de 1 000 fois moins efficace que l’allopurinol, conformément aux données rapportées pour d’autres Salvia espèces. La scutellarine et d'autres flavones ont déjà été décrites comme de puissants inhibiteurs de XO.39. Bien qu'il n'y ait qu'une légère différence dans la teneur totale en flavonoïdes entre l'extrait SF30 et SF70, et que la teneur en autres composés anti-inflammatoires soit plus favorable à l'extrait SF70, le SF30 avait la plus forte capacité à inhiber l'activité XO. Le CI50 la valeur du SF30 était de 50 μg et, sur la base de ce paramètre, l'activité anti-inflammatoire potentielle du SF70, du SF100 et du SFH2Les extraits d’O ont été déterminés comme étant respectivement 3, 4 et 5 fois plus faibles.
[annonce_2]