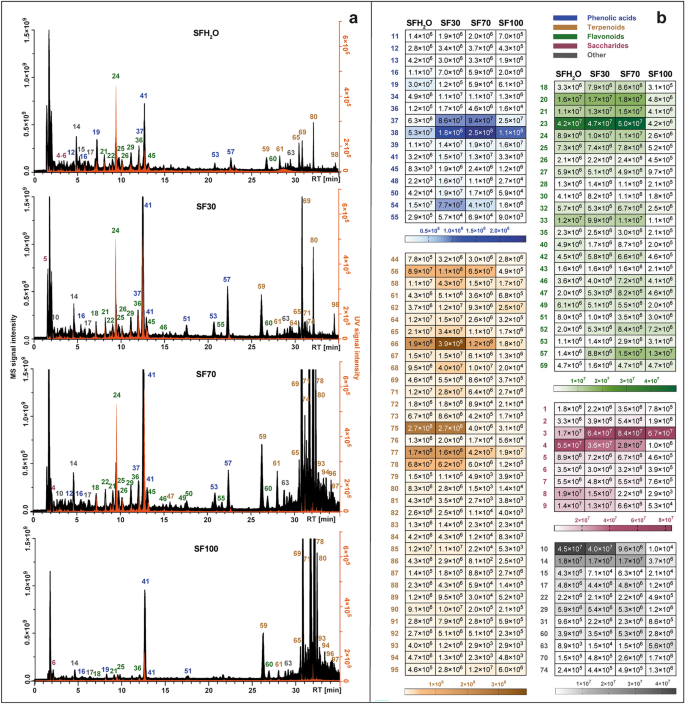
使用 LC-Q-Orbitrap HRMS 进行代谢组学分析
总体而言,代谢组学研究 鼠尾草 负电离模式下的物质往往比正电离模式下的物质更有效15。在本研究中,MS 数据分析包括使用由Compound Discoverer 2.1 软件提供的在线和本地数据库。此外,从之前的代谢组学研究中收集的数据 鼠尾草 收集物种并将其合并到一个大规模清单中,以作为本地数据库实施。共检测到 2704 个物质峰 紫果海棠 负离子模式分析中的提取物。滤除微小信号后(面积 < 104),共有 98 种代谢物,其中 95 种被初步鉴定,如补充表所示 S1.
每种提取物的代谢物概况并列并显示在图中。 1A。不同提取物中的优势群体发生了变化。在用主要含水的溶剂获得的那些中(SFH2O和SF30)最丰富的化合物是酚酸。由于萜类化合物的非极性性质,萜类化合物的提取效率与所用溶剂中乙醇的增加一致。此外,热图显示了四种不同植物化学物质的信号强度 紫果海棠 提取物如图所示。 1b.在研究的提取物中检测到的最多一类化合物是萜类化合物,有 35 种化合物,其次是类黄酮(24 种化合物)、酚酸及其衍生物(19 种化合物)、糖类(9 种化合物)以及其他如脂肪酸、羧酸和未鉴定的化合物。
LC-Q-Orbitrap 在负模式下获得的总离子色谱图(黑色)与 UV-Vis 检测器在 270 nm 处记录的色谱图(橙色)相结合(A),设置热图,代表四种不同色谱中已鉴定化合物的平均 MS 峰面积值 紫果海棠 提取物:SFH2O–水提取物;SF30–30%乙醇提取物;SF70–70%乙醇提取物;SF100–乙醇提取物(乙)。对于峰的识别,请参见补充表 S1.
对于两种极性最大的提取物(SFH2O 和 SF30) 中,酚酸类化合物是总峰面积中最丰富的类群。这类化合物主要以咖啡酸衍生物为代表。化合物的保留时间 (RT) 16 前体离子 [MH]¯ 在 质荷比 179.03419符合咖啡酸标准品的保留时间。它还在以下位置生成了特征主要片段: 质荷比 135.04414,由于二氧化碳的损失。在化合物中检测到了去质子化形式的咖啡酸 40 和 41,被鉴定为鼠尾草酸 ([MH] ́ at 质荷比 719.16210) 和迷迭香酸 ([MH]) 质荷比 359.0773)。通过与标准品进行比较,进一步确认了迷迭香酸的鉴定。在化合物中观察到了相同的离子或其丢失 20, 37, 39, 44, 53, 57 和 58,通过与文献和 MS 的比较来支持2 碎片,被鉴定为丹参苷 ([MH] ́ 质荷比 521.13012)、丹酚酸B ([MH]¯ 在 质荷比 717.14661)、异丹酚酸 B ([MH]¯ 在 质荷比 717.14667)、丹酚酸 K ([MH]¯ 在 质荷比 555.11469), 两种丹酚酸 F 异构体 ([MH] ́ at 质荷比 313.07205) 和丹酚酸 C ([MH]¯ 在 质荷比 491.09863).
在两种非极性提取物(SF70、SF100)中,萜类化合物的贡献最高,而在其余提取物中,此类化合物约占已识别化合物峰面积总和的四分之一。这类化合物主要以二萜类化合物为代表,它们是研究提取物中鉴定出的种类最多的非极性化合物。它们大多是松香烷型二萜类化合物,通过负电离进行裂解通常包括去除 CO2 (-44 Da), CO (-28 Da), H2O (-18 Da), ·CH3 (15 Da)。化合物 59 ([MH] ́ 于 质荷比 345.17075)和 64 ([MH] ́ 于 质荷比 345.17100) 均显示归因于二氧化碳分子损失的离子 (质荷比 301.18097) 和水分子 (质荷比 283.17038 和 质荷比 283.17041),并被鉴定为迷迭香酚和表异迷迭香酚。化合物 69 ([MH] ́ 于 质荷比 329.17580)根据其典型的碎片模式(从二氧化碳的损失开始)被鉴定为鼠尾草酚(质荷比 285.16604)12,15 然后消除甲基自由基(质荷比 270.16211)。化合物中也出现相同的碎片模式 80, 鉴定为 12-甲氧基鼠尾草酸 ([MH]¯ 质荷比 345.20721)与301.21689和286.19385的片段。化合物 78,具有伪分子离子 质荷比 331.19153 [MH]¯ 被鉴定为鼠尾草酸,因为存在与二氧化碳损失和随后异丙基自由基损失相对应的碎片(质荷比 287.20175 和 244.14687)。化合物 70 在 [MH] 处显示前体离子 质荷比 343.15524,生成特征片段 质荷比 315.16028 和 质荷比 299.160504 分别通过乙烯和二氧化碳的损失。这使我们能够识别化合物 70 作为罗斯马迪亚。在测试的提取物中还检测到两种五环三萜类化合物: 96 和 97,初步鉴定为桦木酸和熊果酸,其准分子离子为([MH]¯ at 质荷比 455.35340)。这些三萜类化合物的存在也有报道 紫果海棠 贾什等人。16.
在所研究的提取物中,尤其是含水量较高的提取物(SFH2O、SF30),还观察到寡糖和糖酸在已鉴定化合物的总峰面积中占有很大比例。化合物 1, 2 和 3 初步鉴定为水苏糖、棉子糖和蔗糖,因为它们通常是体内主要的运输糖。 鼠尾草 物种31. 化合物 4–8 被归类为糖酸。化合物的裂解模式 6 ([MH] ́ 于 质荷比 135.02875) 与 我-苏糖酸。化合物 8 ([MH] ́ 于 质荷比 149.0081) 生成的片段 质荷比 72.99171、59.01249 和 87.00734,可在负离子模式下观察到 我-(+)-酒石酸。
检测到的另一类主要植物化学物质 紫果海棠 提取物为黄酮类化合物。大多数已鉴定的属于此类的化合物都被归为黄酮。化合物 24 通过与商业标准的保留时间、紫外光谱和 MS/MS 碎片模式进行比较,明确鉴定为灯盏花素。化合物 46 和 55 显示出几乎相同的前体离子 [MH]¯ 质荷比 299.0563 和 299.0562。化合物 46 产生最丰富的片段 质荷比 284.03253 和 136.98682,类似的复合 55。这些数据与组毛蛋白或香叶木丁的碎片模式相对应。由于保留时间存在差异,两种化合物都可能存在于 紫果海棠 提取物。化合物 49 在 [MH] 处显示前体离子 质荷比 285.04065 形成特定产物离子 质荷比 133.02834, 151.00261, 175.03903,与 Velamuri 等人报道的木犀草素一致。17。 化合物 52 ([MH] ́ 于 质荷比 327.21786) 被鉴定为 salvigenin (果胶黄素-7-甲基醚),因为这种黄酮以前曾在 紫果海棠。 化合物 54 产生基峰 [MH] ́ 质荷比 269.04578. 前体离子和产物离子 质荷比 117.03332和151.00264证实该化合物为芹菜素。化合物 56 给出前体离子 [MH] ́ 质荷比 329.0668,表明其分子式为C17H14氧7. 它在 质荷比 299.01981归因于失去两个甲基,271.02472归因于进一步消除一氧化碳。因此,该峰被鉴定为jaceosidin。化合物 60 根据前体离子 [MH]¯ 确定为 cisimaritin 质荷比 313.07190 和诊断产物离子 质荷比 298.04694和283.02478,表明由于一氧化碳的消除而损失了两个甲基自由基和255.02974。化合物 62 ([MH] ́ 于 质荷比 283.06137) 对应于芹菜素衍生物,因为片段 质荷比 268.03772 和 117.03318。特征碎片离子 质荷比 240.04193 一氧化碳损失导致化合物 62 经鉴定为芫花素。芹菜素、hispidulin、cirsimaritin 和芫花素的裂解模式与 Koutsoulas 等人报道的一致。12。 化合物 50 是研究提取物中检测到的唯一类型的黄酮醇苷元。前体离子 [MH]¯ 在 质荷比 315.0513 和主要 MS/MS 片段位于 质荷比 300.02756 由于甲基基团的丢失,该化合物被鉴定为异鼠李素。化合物 30 与准分子离子 [MH] ́ 在 质荷比 609.18329 没有显示任何碎片,但由于之前曾报道过 紫果海棠18,19,初步鉴定为黄酮—橙皮苷。本研究发现的黄酮苷类化合物主要为特征片段为162Da的苷类、葡萄糖醛酸苷(176Da)和芸香糖苷(308Da)。木犀草素葡萄糖苷(化合物 22 其中 [MH]¯ 质荷比 447.09344) 出现在大多数关于化学成分的出版物中 紫果海棠 提取物12,18,19,20,21。 化合物 26 显示出前体离子 [MH] ́ 质荷比 491.0836,并被鉴定为异鼠李素葡萄糖醛酸苷,早先在 紫果海棠 仅由 Gürbüz 等人22。 化合物 27 ([MH]¯ 在 质荷比 Cvetkovikj 等人也在希腊鼠尾草中发现了芹菜素-芸香苷(577.15668),被鉴定为芹菜素-芸香苷。21.
还观察到脂肪酸的存在 紫果海棠 提取物。化合物 63 和 73 初步鉴定为两种多不饱和脂肪酸。化合物 63 被指定为二羟基十八碳二烯酸(C18H31氧4化合物 73 产生前体离子 [MH] ́ 质荷比 295.22803 和特征片段 米/z 277.21738 ([MHH2欧]- 和 195.13837 [M-(CHO-(CH2)4—CH3)-H]¯,表示羟基位于13位碳原子。因此,鉴定为13-羟基-9,11-十八碳二烯酸。此外,在 紫果海棠 提取结核酸葡萄糖苷的存在(质荷比 387.16644) (化合物 14),这是一种生长激素,被观察到。
主要植物化学物质的定量分析
不同提取物中主要酚类化合物的定量分析 紫果海棠 植物材料的干重 (mg/g DW) 列于表中 1咖啡酸、灯盏花苷、丹酚酸B、迷迭香酸、鼠尾草酸和鼠尾草酚的含量是根据标准品的校准曲线计算出来的,而其他化合物的含量则是根据最相似的现有标准品来估算的。
总体而言,鼠尾草提取物中最丰富的化合物是迷迭香酸,它是一种酚酸和咖啡酸的二聚体。在所有测试样品中,迷迭香酸浓度最高的是 SF70(31.56 ± 1.88 mg/g DW),与鼠尾草提取物中的迷迭香酸浓度相同 紫果海棠 Mervić 等人报道,从克罗地亚采集(29.10 ± 0.21 mg/g DW)。23Sarrou 等人研究的希腊鼠尾草甲醇提取物中含有更高的含量 (60.73 mg/g DW)。19,但在本研究中使用纯酒精作为溶剂并没有获得最高的迷迭香酸产率。输液中迷迭香酸浓度(SFH2O) 的含量 (4.96 ± 0.65 mg/g DW) 比其他提取物低得多,这与对土耳其品种进行的类似比较的结果不一致。 紫果海棠 通过泰金18. 在所有研究的提取物中都检测到了相似浓度 (0.13–0.15 mg/g DW) 的咖啡酸,比 Mervić 等人报告的浓度低十倍。23。然而,丹酚酸(属于鼠尾草植物中主要的咖啡酸衍生三聚体)的含量很少。 SF70 和 SF30 提取物中丹酚酸 B 的浓度最高(6.86 ± 0.93 mg/g DW 和 6.52 ± 0.48 mg/g DW)。 ST30 提取物中丹酚酸 K 的含量最丰富,浓度为 6.25 ± 1.0 mg/g DW。根据 Cvetkovikj 等人提供的数据。21,在几个研究的希腊人群中,丹酚酸 K 的最大浓度 紫果海棠 为7.20毫克/克干重。
中含量最丰富的萜类化合物 紫果海棠 分别是鼠尾草酸和鼠尾草酚,它们都属于松香烷二萜类化合物12。SF100 中鼠尾草酸含量最高(14.82 ± 1.66 mg/g DW),其次是 SF70(13.88 ± 2.52 mg/g DW),统计学上没有差异。这些结果与 Kallimanis 等人在甲醇提取物中测得的含量一致。24 为 12.5 ± 1.6 mg/g DW。SF70 提取物中的鼠尾草酚含量为 7.88 ± 1.33 mg/g DW,与 Sarrou 等人的报道一致。19。丹参酚是所研究的提取物中第三丰富的萜类化合物,是一种源自松香烷二萜类化合物铁鲁吉醇的类萜,在其他希腊鼠尾草物种中很常见,例如 S. pomifera25。该化合物尚未见报道 紫果海棠;然而它存在于大多数研究的提取物中,含量最高:SF70 中为 7.37 ± 0.71 mg/g DW。
检测到的第三组生物活性物质 紫果海棠 提取物是黄酮类化合物。黄芩苷是鼠尾草中常见的黄酮类化合物之一26。它是所研究的提取物中最丰富的类黄酮,且产量相似:SFH 中的 7.77 ± 0.48 mg/g DW、8.92 ± 1.56 mg/g DW 和 7.35 ± 0.9 mg/g DW2分别为 O、SF30 和 SF70 提取物。所有研究提取物中木犀草素芸香苷和木犀草素葡萄糖苷的浓度相似,范围为 1.03 至 1.98 mg/g DW,这与 Tekin 等人报道的数据不一致。18,其中这些化合物在鼠尾草浸液中的浓度比乙醇提取物中的浓度高两到三倍。
酚酸类、黄酮类和萜类化合物是 紫果海棠.如表所示 1,提取率受溶剂中乙醇含量的影响很大。与仅用水提取相比,用 70% 乙醇提取可获得最高的生物活性物质总产量。酚酸和萜类化合物的产量差异明显,SF70 中的产量分别高出三倍和七倍。用 30% 乙醇可获得最大的黄酮类化合物提取产量,但仅略高于用 70% 乙醇获得的产量。考虑到所有研究的生物活性物质组,70% 乙醇是测试的用于从植物中提取生物活性化合物的最佳溶剂 紫果海棠.
抗氧化活性
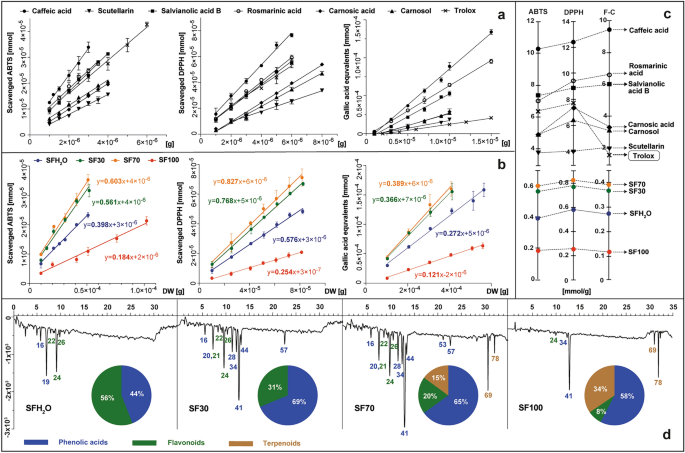
植物材料中存在具有抗氧化活性的化合物已成为定义其促进健康特性的重要方面。就各种鼠尾草而言,其高抗氧化活性主要由酚类化合物引起。在本文的研究中,确定了总抗氧化活性 紫果海棠 用不同极性的萃取剂制备的提取物。此外,还确定了鼠尾草中典型的选定酚类化合物的抗氧化活性,这些化合物属于各种次生代谢产物,例如酚酸、黄酮和二萜类化合物。
本研究比较了使用 ABTS、DPPH 和 Folin-Ciocalteu (F-C) 试剂的三种最流行的分光光度测试的结果。 ABTS 和 DPPH 测定广泛用于测定提取物的自由基清除活性,纯化合物也是如此。为了 紫果海棠 提取物中,计算的抗氧化活性描述了反应 10 分钟后 1 g 干燥材料中的抗氧化剂减少的 ABTS 或 DPPH 分子的数量。这些值是在方法的线性范围内计算的,并表示为描述还原的氧化剂毫摩尔数与不同量的测试样品之间关系的直线斜率——以反应混合物中的干物质克数表示(图1)。 2b).
标准品(咖啡酸、灯盏花苷、丹酚酸 B、迷迭香酸、鼠尾草酸、鼠尾草酚和水溶性维生素 E)的抗氧化活性和 紫果海棠 提取物:SFH2O——水提取物; SF30–30%乙醇提取物; SF70–70%乙醇提取物; SF100-乙醇提取物,使用 ABTS、DPPH 和 F-C 试剂进行体外测试,以图形式显示试剂的依赖性曲线,该曲线通过测试标准降低(A)或摘录(乙) 并表示为曲线的斜率等于 1 g 测试样品减少的试剂毫摩尔数 (C) 是提取物的抗氧化剂概况,在用 ABTS 进行柱后衍生化后在 734 nm 处记录,饼图上显示了抗氧化剂的主要类别(d)。对于峰的识别,请参见补充表 S1.
该研究还包括使用 Folin-Ciocalteu 试剂的方法。该方法包括在碱性环境中将电子从具有活性羟基的化合物转移到磷钼磷钨酸复合物。在这种情况下,还原能力表示为形成蓝色复合物并从 1 克植物干物质中提取的没食子酸当量的毫摩尔数。对于鼠尾草中存在的选定纯物质,例如:咖啡酸、鼠尾草酸、鼠尾草酚、丹酚酸 B、灯盏花苷、迷迭香酸,以及参考抗氧化剂——trolox(图)。 2A)。 Kusznierewicz 等人先前描述了这种测定和计算植物材料和纯物质的抗氧化活性的方法。27 和 Baranowska 等人28分别。对标准和样品进行的每次测试所得的斜率值分别绘制在单独的轴上(图。 2C)。每种测试的酚类标准品均表现出抗氧化活性,按如下顺序递增:灯盏乙素 < 鼠尾草酚 < 鼠尾草酸 < 丹酚酸 B < 迷迭香酸 < 咖啡酸。其中三种——丹酚酸 B、迷迭香酸和咖啡酸——比维生素E更有效,维生素E是一种在抗氧化活性测定中常用作参考的化合物。所有研究的提取物的抗氧化活性 紫果海棠 在 ABTS 测定以及 DPPH 测试中呈剂量依赖性。因此,随着添加到反应混合物中的提取物的量增加,对这些自由基的还原能力也增加。 SF100 提取物的总抗氧化活性最低,其次是 SFH 的几乎两倍2O,SF30 和 SF70 高出近四倍。F-C 测试结果与 ABTS 和 DPPH 趋势相同,Pearson 相关性为 0.99,这表明提取物的抗氧化活性很大程度上取决于酚类物质的含量,正如 Lantzouraki 等人所证实的那样。29.
根据提取物中选择测试的 6 种植物化学物质的含量(表 1)以及它们和提取物的抗氧化活性(图 1)。 2a、c),我们可以确定这些化合物对单个提取物总抗氧化活性的估计贡献。就 SFH 而言2O、SF30 和 SF70 提取物,6 种选定的化合物,根据测试,理论上分别覆盖了测定的总抗氧化活性的 21-30%、45-63% 和 64-86%。这些结果表明这些提取物中可能存在其他额外的抗氧化剂和/或其协同作用。仅在 SF100 提取物的情况下,6 种标准化合物的活性总和超过了该提取物测定的总活性,范围为 20 至 49%,具体取决于所使用的测试。这种观察结果可能是这种提取物中存在的植物化学物质之间可能存在拮抗相互作用的结果。
关于测试中抗氧化剂类型的更多详细信息 紫果海棠 通过使用 ABTS 试剂进行 HPLC 柱后衍生化来提供提取物。通过该方法获得的抗氧化谱,以及不同类别的抗氧化剂在总抗氧化活性中的贡献,如图1所示。 2d. 除了之前测试的 6 种标准抗氧化剂外, 紫果海棠 提取物还含有其他抗氧化剂,如普氏原酸 A、丹参黄苷、木犀草素芸香苷、木犀草素葡萄糖苷、异鼠李素葡萄糖苷酸、香豆酰咖啡酰糖苷、丹酚酸 K 和丹酚酸 F。 SF70 和 SF30 提取物中观察到 ABTS 自由基。尽管这两个样品的抗氧化特性相似,但 SF70 的共同信号强度较高,并且还注意到源自二萜类化合物的额外活性。仅在 SF70 和 SF100 提取物的谱中观察到源自二萜类化合物的负峰,其在总抗自由基活性中的份额分别为 15 和 34%。所有含有乙醇的提取物中的主要抗氧化剂是迷迭香酸——最丰富的酚酸,也是研究标准中最强的抗氧化剂之一。也报告了相同的结果 药用植物 和 西班牙沙门氏菌 提取物30,31.
水提取物(SFH2O) 抗氧化活性主要来自两种化合物:普氏野酸 A 和灯盏花乙素,因为单独用水提取迷迭香酸效果较差。
黄嘌呤氧化酶抑制活性
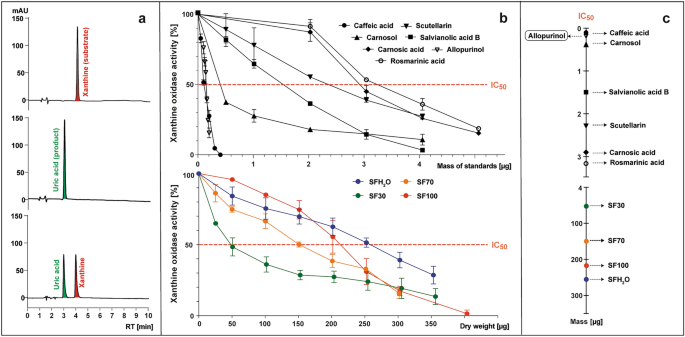
黄嘌呤氧化酶 (XO) 催化次黄嘌呤和黄嘌呤氧化为尿酸,血液中尿酸过量会导致痛风。在 XO 再氧化过程中,分子氧充当电子受体,产生超氧自由基和过氧化氢。因此,XO被认为是超氧自由基的重要生物来源,超氧自由基与其他活性氧一起导致人体氧化应激,并参与许多病理过程,如炎症、动脉粥样硬化、癌症、衰老等。32。治疗高尿酸血症的最新方法是抑制XO酶。已经开发出各种含有XO抑制剂(别嘌呤醇、非布索坦)的药物,但不幸的是,使用这些药物会产生某些副作用。因此,人们一直在寻找天然的XO抑制剂,以替代这些合成化合物。文献中有一些关于几种 鼠尾草 (蒲公英、丹参、马鞭草) 抑制 XO33,34,35因此,在研究中也测试了这种活动发生的可能 紫果海棠 提取物。此外,还测定了鼠尾草中某些典型的酚类化合物的XO抑制活性,例如:咖啡酸、鼠尾草酸、鼠尾草酚、丹酚酸B、灯盏花苷、迷迭香酸,以及XO抑制剂别嘌呤醇。
使用 HPLC-PAD 在 285 nm 处监测 XO 在存在或不存在测试样品的情况下将黄嘌呤(底物)转化为尿酸(产物)的情况(图 1)。 3A)。酶活性计算为在测试样品存在下形成的尿酸峰面积与不添加样品的对照相比的百分比(图1)。 3b). XO 酶的抑制以 IC50 表示50 值,是指能够将酶活性降低至50%的标准质量或样品干重(μg)(图1)。 3公元前)。
使用已知的 XO 抑制剂别嘌呤醇作为参考,IC50 值为 0.15 µg (5.5 µM)。所有研究的标准品都显示了 IC 的 XO 抑制活性50 浓度范围为 0.1 至 3.15 μg (2.8–43.8 µM)。XO 抑制活性依次增加:迷迭香酸 < 鼠尾草酸 < 灯盏花苷 < 丹酚酸 B < 鼠尾草酚 < 咖啡酸。咖啡酸的 IC 值最低50 值(0.1 μg; 2.8 µM),表明在测试的化合物中XO抑制活性最强。它甚至比别嘌呤醇还强,这与Wan等人提供的数据不一致。36 和弗莱米格等人。37,其中IC50 咖啡酸的抑制作用分别比别嘌呤醇低近 8 倍或 2 倍。这些差异可能是由于测试所选的 XO 的来源不同造成的。在引用的研究中,使用的是牛奶中的氧化酶,而本研究选择了微生物氧化酶。在本研究中,迷迭香酸对 XO 的抑制作用最低(3.2 μg;43.8 µM),但 Ghallab 等人。38 据报道,别嘌呤醇和迷迭香酸的协同组合可以降低所需合成药物的剂量。 XO 被所有研究抑制 紫果海棠 提取物,虽然效果比别嘌呤醇低 1000 多倍,但与其他报告的数据一致 鼠尾草 物种。灯盏乙素和其他黄酮先前已被描述为 XO 的强抑制剂39尽管SF30和SF70提取物的总黄酮含量差别不大,且SF70提取物中其他抗炎成分含量更高,但SF30对XO活性的抑制能力最强。IC50 SF30 的值为 50 μg,根据该参数,SF70、SF100 和 SFH 的潜在抗炎活性2O提取物的强度分别被测定为3倍、4倍和5倍。
[广告_2]